Exercice 6 :

Rayons de covalence des atomes :
Z*C = 3,25 et n*C = 2 è RC = 0,786 A°
Z*O = 4,55 et n*O = 2 è RO = 0,710 A°
RH = 0,346 A°
Soit pour les longueurs des liaisons :
C - O : 1,46 A°
C = O : 1,25 A°
C - H : 1,05 A°
O - H : 0,97 A°
O - O : 1,37 A°
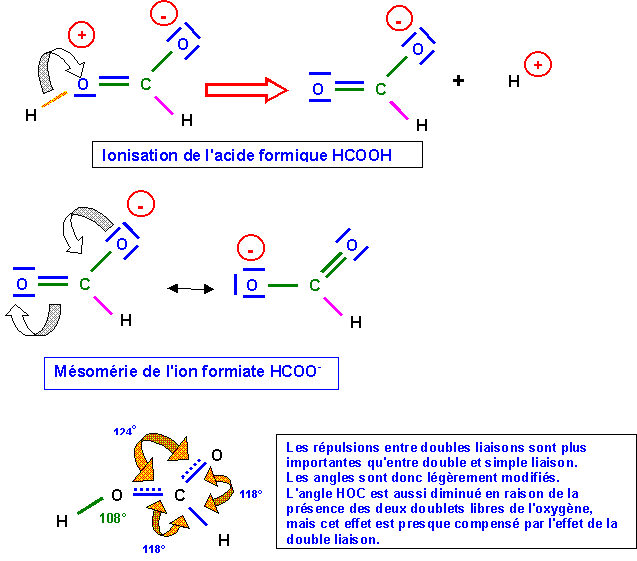
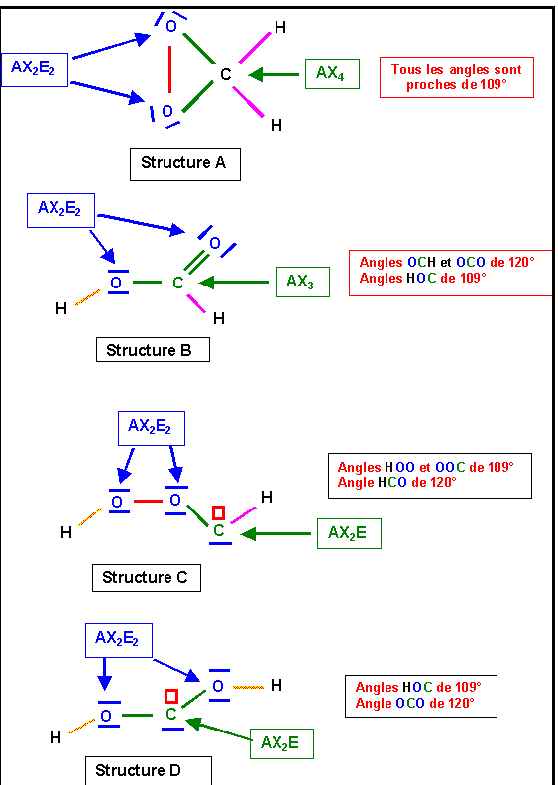
Acide Formique HCOOH
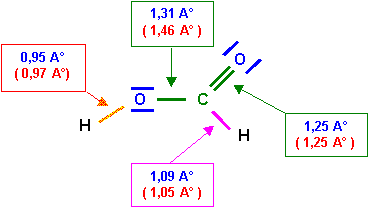
La simple liaison C - O est en réalité plus courte que la valeur approchée calculée grâce à la formule. L'accord est tout à fait satisfaisant pour les autres liaisons.
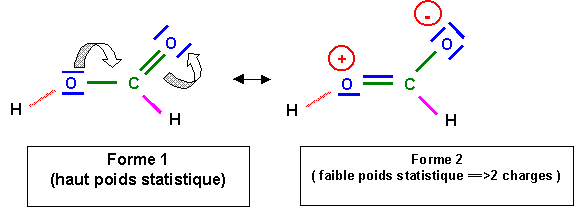
La liaison C - O à un faible caractère de double liaison à cause de la forme 2, cette liaison sera donc intermédiaire entre la simple et la double. Sa longueur de 1,31 A° est bien intermédiaire entre 1,25 et 1,46 A°. La longueur de la double liaison (qui devrait normalement légèrement augmenter) n'est en revanche pas sensiblement modifié, cela est général, les effets de raccourcissement sont toujours nettement plus sensibles que les effets d'allongement.
Dans la forme 2, l'atome d'oxygène lié a H porte une charge formelle positive, l'oxygène étant très électronégatif va chercher à se "débarrasser "de cette charge positive, pour cela il va "voler" les électrons de liaisons avec H. On obtient alors l'ion formiate HCOO- et H+ est libéré ce qui explique l'acidité importante de HCOOH.