Exercice 6 :
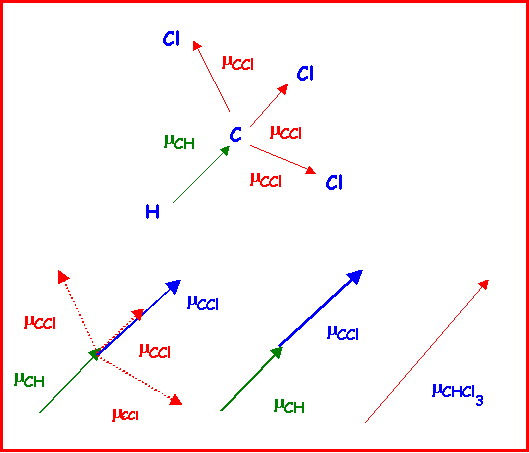
Quel moment dipolaire peut on attribuer au chloroforme CHCl3 sachant que les moments partiels de liaisons sont mCH = 0,4 D et mCCl = 1,5 D
CHCl3 présente une géométrie tétraédrique de type AX4
Orientons d'abord les vecteurs moment dipolaire de liaison :
Classement des atomes par ordre d'électronégativité croissante : H < C < Cl
Liaison C-H : Vecteur mCH dirigé de H vers C
Liaison C-Cl : Vecteur mCCl dirigé de C vers Cl
On pourrait chercher à résoudre ce problème géométrique par le calcul par addition vectorielle successives, mais il est plus simple de tenir compte des simplifications pour raison de symétrie.
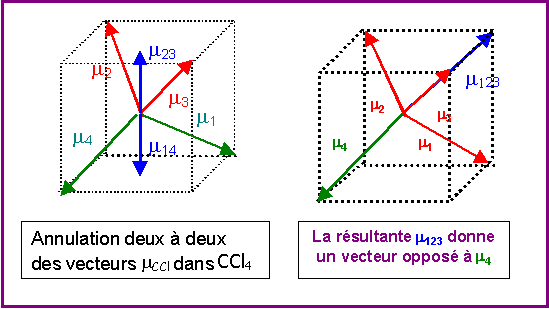
Pour des raisons de symétrie (voir figure) les molécules de type AX4 comme CCl4 ne possèdent pas de moment dipolaire permanent, en effet les moments dipolaires partiels des liaisons C- Cl s'annulent deux à deux et le moment global résultant est nul.
On peut donc considérer simplement que l'addition vectorielle de 3 moments de liaisons C-Cl donne un vecteur exactement opposé a moment dipolaire de la quatrième liaison C-Cl
On peut donc remplacer 3 vecteurs mCCl par un seul opposé au 4ème.

On peut utiliser cette propriété pour calculer facilement le moment dipolaire global de CHCl3.
On suppose pour simplifier que CHCl3 à une géométrie tétraédrique parfaite.
On remplace les trois vecteurs mCCl par un seul vecteur de même norme et dont on sait qu'il se trouve dans le prolongement du vecteur mCH. Le moment global est la somme de ces deux vecteurs colinéaires et de même sens.
Soit mCHCl3 = mCH + mCCl = 0,4 + 1,5 = 1,9 D