Exercice 2 :
On donne les masses molaires et les points d’ébullition des composés hydrogénés des éléments de la colonne 15 de la classification périodique :
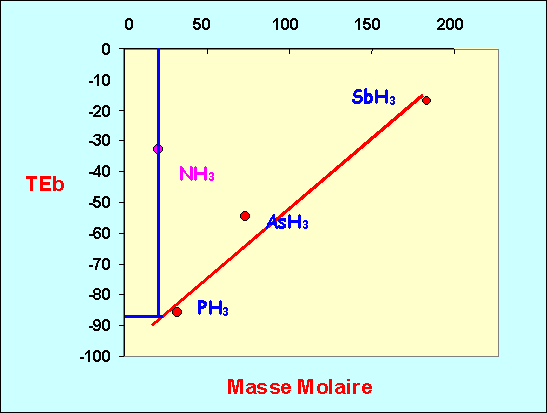
NH3 , PH3 , AsH3 et SbH3
M (g mol-1) |
Teb (°C) |
|
NH3 |
17 |
-33 |
PH3 |
34 |
-87 |
AsH3 |
78 |
-55 |
SbH3 |
181 |
-17 |
Montrer que l’un des composés possède un point d’ébullition " anormal ". Lequel ?
Evaluer le point d’ébullition que devrait avoir " normalement " ce composé.
Justifier cette anomalie.
Une représentation graphique montre clairement que NH3 présente des températures de changement d'état anormalement élevées par rapport aux autres composés hydrogénés des éléments de la même colonne.
On explique cela par l'existence de fortes interactions de Keesom dues au liaisons N -H fortement polarisées (XN = 3,0 et XH = 2,2).
Ces interactions particulièrement importantes sont nommées liaisons Hydrogène.
On peut estimer graphiquement que NH3 devrait avoir un point d'ébullition d'environ - 90°C si ces interactions n'existaient pas.
