Exercice 2 :
Décrire la géométrie, l’hybridation des atomes de carbone et les liaisons dans les molécules suivantes :
CH2=CH2 , HCOOH , HCHO , CH2 = C =CH2
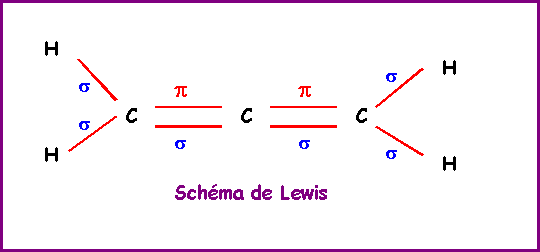
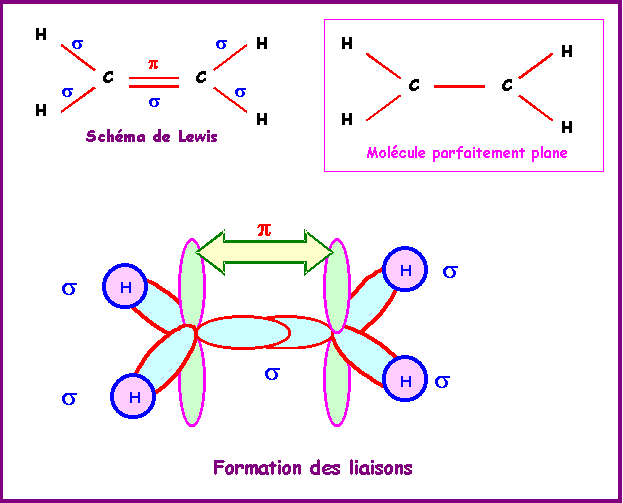
Ethylène : CH2 = CH2
La géométrie autour des deux atomes de Carbone est du type AX3 soit une hybridation trigonale de type sp2. La méthode R.P.E.C.V prévoit une géométrie basée sur deux triangles équilatéraux mais ne dit rien sur la co-planéité ou non de ces deux triangles. Le modèle quantique en revanche prévoit une planéité totale de la molécule. En effet les deux orbitales p ne peuvent se recouvrir latéralement pour donner la liaison p que si elles sont parfaitement parallèles entre elles. Les orbitales sp2 doivent donc toutes être dans le même plan.

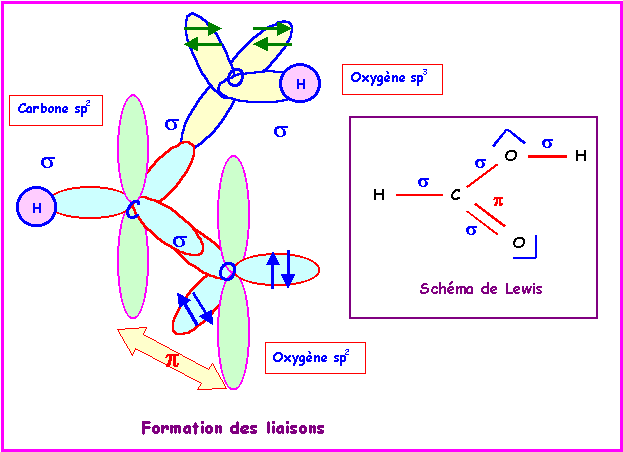
Acide méthanoïque : HCOOH
Le schéma de Lewis de la molécule montre que la géométrie est du type AX3 autour du carbone et AX2E2 autour de l'oxygène porteur de l'atome d'hydrogène. Enfin, on peut considérer qu'elle est du type AXE2 autour de l'autre atome d'oxygène.
On a donc des hybridations du type :
sp2 pour C
sp3 pour le O de OH
sp2 pour le O de C=O
Pour simplifier le problème nous ne tiendrons compte que de la forme mésomère principale et nous négligerons la conjugaison (voir série 1).
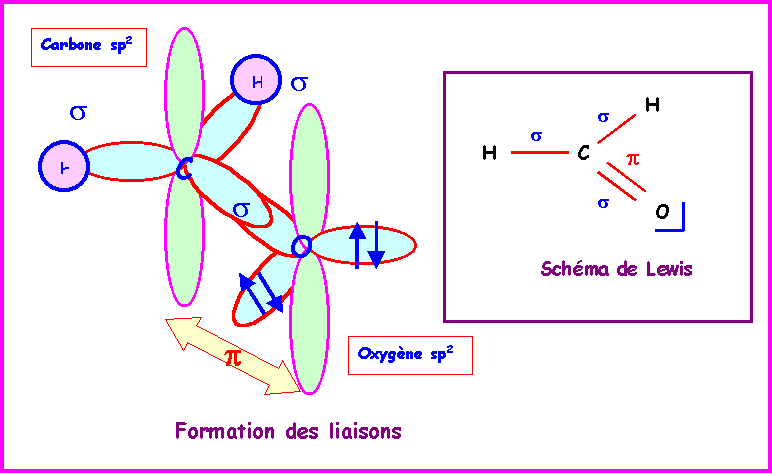
Méthanal : HCHO
Le Carbone central est hybridé sp2 pour une géométrie trigonale de type AX3, la molécule est plane.
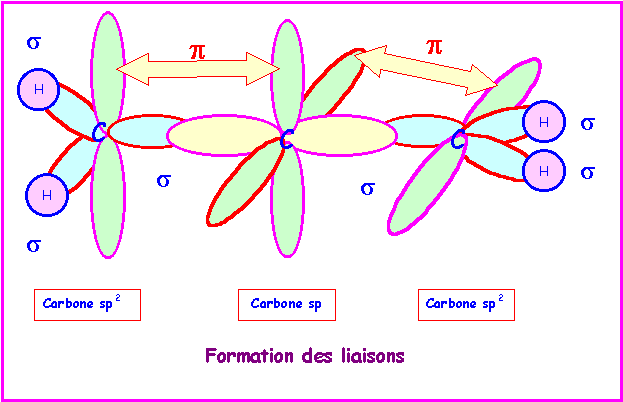
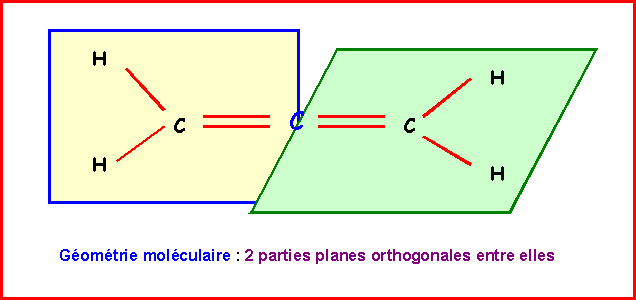
Allène : CH2 = C = CH2
Atome |
CH2 |
= C = |
CH2 |
Géométrie |
AX3 |
AX2 |
AX3 |
Hybridation |
sp2 |
sp |
sp2 |
Les deux doubles liaisons sur le même atome de Carbone imposent deux parties planes contenues dans deux plans perpendiculaires entre eux.