Exercice 3
Molécules C2 et O2
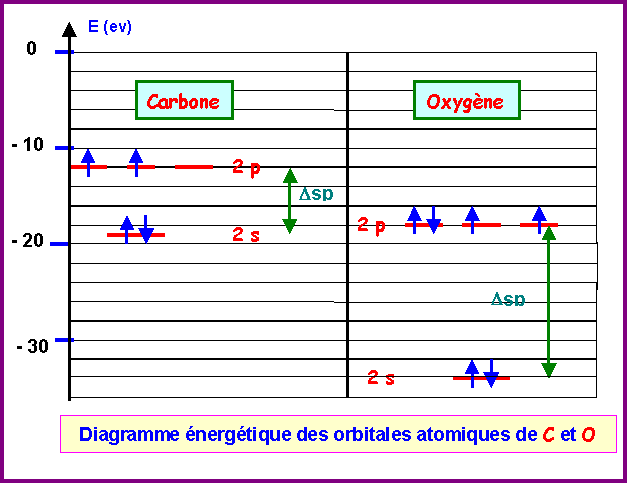
Seules les orbitales de valence sont prises en compte, les électrons de cœur n'intervenant pas dans les propriétés chimiques.

Les interactions sp seront importantes pour C2 et négligeables pour O2.
En effet, l'écart Dsp est faible dans le cas du Carbone ( Dsp = 19 -11,7 = 7,3 eV) et important dans le cas de l'Oxygène ( Dsp = 33,7 -17,1 = 16,6 eV).
e)
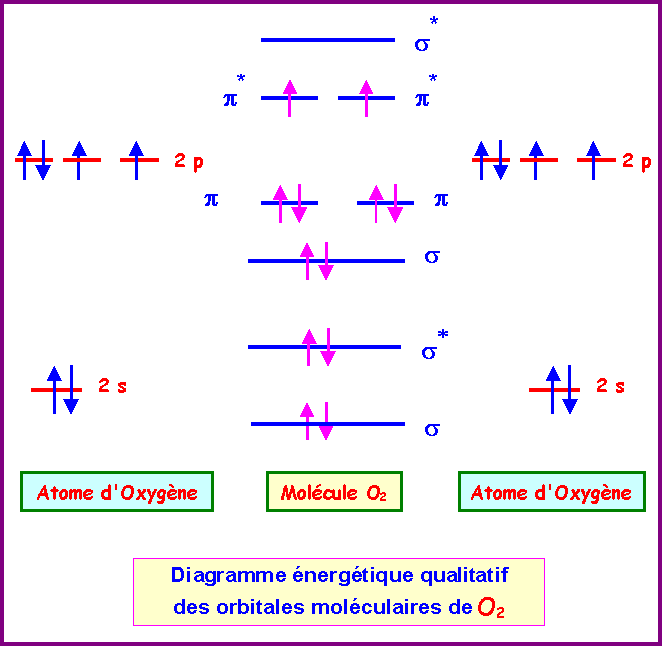
Cas de O2
La configuration électronique de O2 peut s'écrire :
s12 - s1*2 - s22 - p12 - p22 - p1*1 - p2*1 - s2*0
L'indice de liaison dans O2 est de :
nl = 1/2( n - n*) = 1/2 ( 8 - 4 ) = 2
Si on ajoute un électron pour former O2- l'électron supplémentaire se placera sur le premier niveau vacant (non complètement occupé) c'est à dire ici p1*.
L'ajout d'un électron sur un niveau anti liant déstabilise la molécule, cela se traduit par une diminution de l'énergie de dissociation et à une augmentation de la longueur de la liaison. On peut vérifier cela en calculant l'indice de liaison dans O2-.
nl = 1/2( n - n*) = 1/2 ( 8 - 5 ) = 1,5
Si on enlève un électron pour former O2+ l'électron partant sera celui de plus haute énergie c'est à dire situé sur le dernier niveau occupé, ici p1* ( ou p2* ) .
Le départ d'un électron sur un niveau anti liant stabilise la, cela se traduit par une augmentation de l'énergie de dissociation et à une diminution de la longueur de la liaison.
On peut vérifier cela en calculant l'indice de liaison dans O2+.
nl = 1/2( n - n*) = 1/2 ( 8 - 3 ) = 2,5
Finalement on retrouve bien l'ordre des longueurs de liaison :
d O2+ < dO2 < d O2-
Règles :
Plus une liaison est forte (indice de liaison élevé) et plus sa longueur est courte.
Plus une liaison est faible (indice de liaison faible) et plus sa longueur est grande.
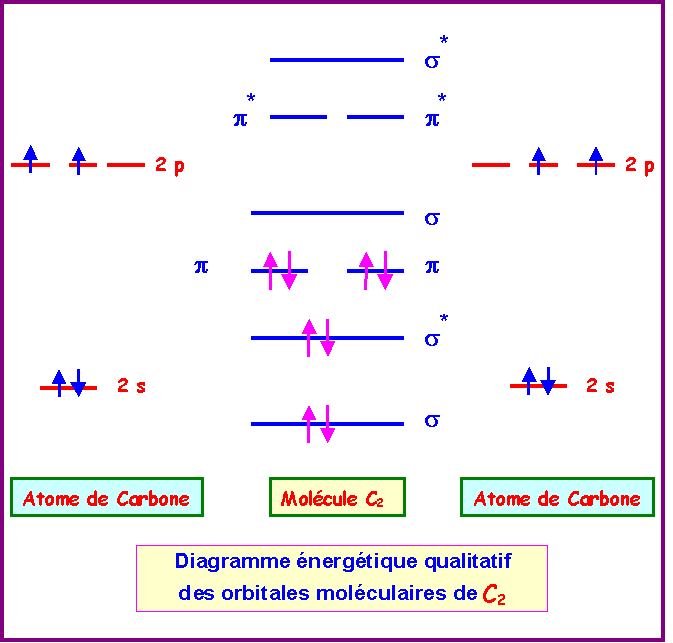
Cas de C2
La configuration électronique de C2 peut s'écrire :
s12 - s1*2 - p12 - p22 - s20 - p1*0 - p2*0 - s2*0
L'indice de liaison dans C2 est de :
nl = 1/2 ( n - n* ) = 1/2 ( 6 - 2 ) = 2
Si on ajoute un électron pour former C2- l'électron supplémentaire se placera sur le premier niveau vacant (non complètement occupé) c'est à dire ici s2.
L'ajout d'un électron sur un niveau liant stabilise la molécule, cela se traduit par une augmentation de l'énergie de dissociation et à une diminution de la longueur de la liaison. On peut vérifier cela en calculant l'indice de liaison dans C2-.
nl = 1/2( n - n*) = 1/2 ( 7 - 2 ) = 2,5
Si on enlève un électron pour former C2+ l'électron partant sera celui de plus haute énergie c'est à dire situé sur le dernier niveau occupé, ici p1( ou p2 ) .
Le départ d'un électron sur un niveau liant déstabilise la molécule, cela se traduit par une diminution de l'énergie de dissociation et à une augmentation de la longueur de la liaison. On peut vérifier cela en calculant l'indice de liaison dans C2+.
nl = 1/2( n - n*) = 1/2 ( 5 - 2 ) = 1,5
Finalement on retrouve bien l'ordre des longueurs de liaison :
d C2+ > d C2 > d C2-
Règles :
Plus une liaison est forte (indice de liaison élevé) et plus sa longueur est courte.
Plus une liaison est faible (indice de liaison faible) et plus sa longueur est grande.
f) Par le même raisonnement on trouve que l'ordre croissant de stabilité est :
O2- < O2 < O2+
Plus une molécule est stable et plus son énergie de dissociation D est élevée donc :
D O2- < D O2 < D O2+
Règles :
Plus une liaison est forte (indice de liaison élevé) et plus son énergie de dissociation est élevée.
Plus une liaison est faible (indice de liaison faible) et plus son énergie de dissociation est faible.
2) Molécule CO :
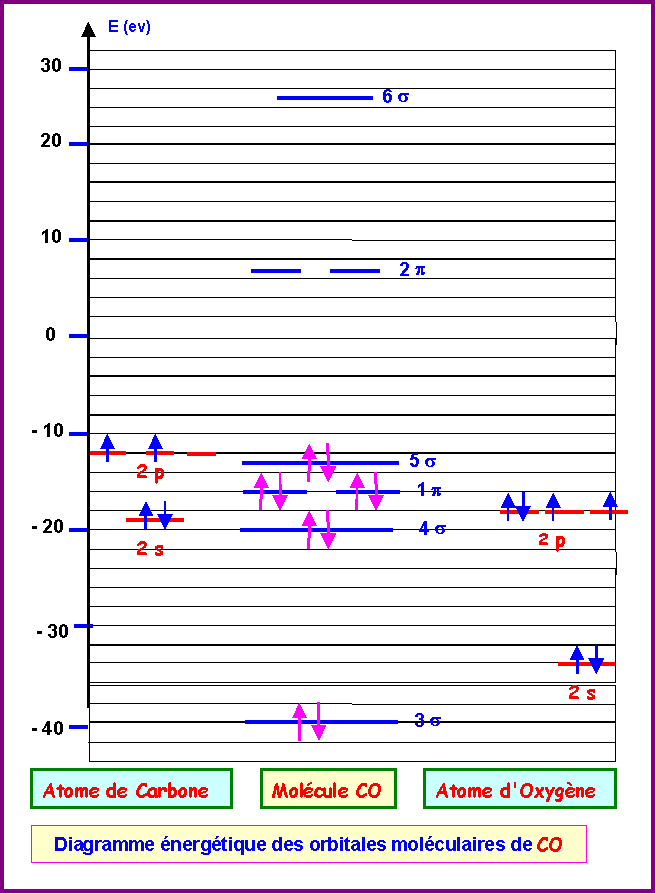
Attribution des caractères liant ou anti-liant aux diverses orbitales moléculaires :
Le modèle qualitatif décrit dans le cours pour les molécules homo-nucléaires est un peu trop simpliste pour pouvoir décrire correctement toutes les molécules. Des calculs très complexes sont en réalité nécessaires pour cela. Nous n'aborderons pas ici de tels calculs, nous allons tout de même voir "qualitativement" dans ce cas les modifications qu'on peut y apporter.
On reconnaît le schéma typique d'une molécule avec interactions sp par l'ordre d'apparition des diverses orbitales moléculaires:
3s - 4s - 1p - 5s - 2p - 6s
A priori on doit donc avoir les caractères suivants :
3 s: orbitale liante (contient 2 électrons)
4s : orbitale anti-liante (contient 2 électrons)
1p : orbitale liante (contient 4 électrons)
5s : orbitale liante (contient 2 électrons)
2p : orbitale anti-liante (contient 0 électrons)
6s : orbitale anti-liante (contient 0 électrons)
S'il en est ainsi l'indice de liaison de CO est de :
nl = 1/2( n - n*) = 1/2 ( 8 - 2 ) = 3
Le dernier niveau occupé 5s est un niveau liant et si on arrache un électron pour former CO+ on déstabilise la molécule, l'indice de liaison diminue et la longueur de liaison devrait donc augmenter.
Pour CO+ : nl = 1/2( n - n*) = 1/2 ( 7 - 2 ) = 2,5
En fait, la longueur de liaison reste pratiquement inchangée. Cela s'explique par le fait que les orbitales moléculaires ne sont pas toujours franchement liantes (ou anti-liantes). Si leur énergie est très proche des énergies des orbitales atomiques, la stabilisation (ou la déstabilisation) sont en pratique très faibles.
Ainsi, l'orbitale 5s n'est en réalité que très faiblement liante, le fait d'enlever un électron de cette orbitale ne va donc que très peu déstabiliser la molécule et la longueur de liaison ne va en fait que très faiblement varier.