Exercice 2:
On s’intéresse à la géométrie de
la molécule de prop-2-énal : CH2
= CH - CHO
- en appliquant la méthode V.S.E.P.R
donner la géométrie autour de chaque carbone. Peut-on
prévoir la géométrie globale de la molécule ?
La V.S.E.P.R prévoit une
géométrie triangulaire plane autour des trois atomes de
Carbone, mais l'orientation de ces différents plans les
uns par rapport aux autres peut a priori être
quelconque.
La géométrie
globale de la molécule n'est donc pas connue avec
précision.
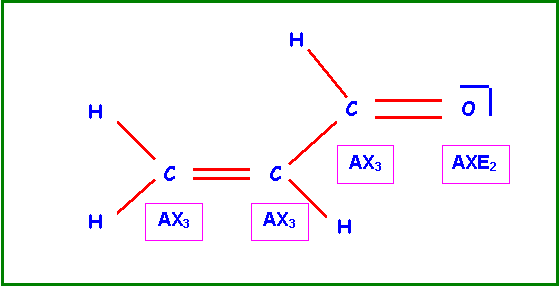
- L’expérience montre que la
molécule est plane. Représenter le système p et
justifier ce fait expérimental.
L'hybridation qui convient
pour décrire la géométrie AX3 est l'hybridation sp2.
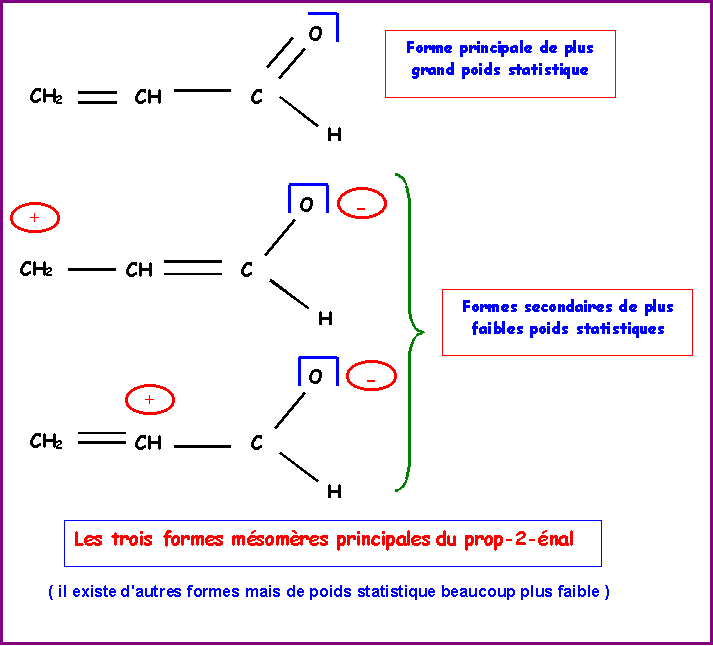
On se limite pour l'instant
a la seule forme mésomère principale telle qu'elle est écrite
dans l'énoncé :
CH2 = CH - CHO
On peut alors décrire la
formation des liaisons de la manière suivante :
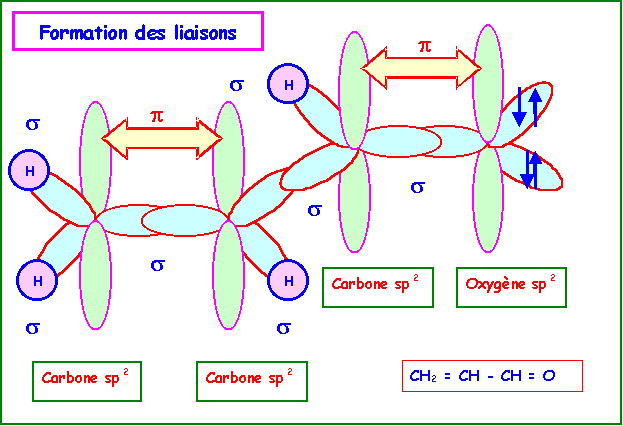
L'existence des
liaisons p va introduire des contraintes géométriques, en
effet les orbitales p participant a ces liaisons doivent être
parallèles pour pouvoir se recouvrir efficacement, cela n'est
possible que si les orbitales hybrides sp2 sont
coplanaires deux à deux. Cette conditions impose donc a la
molécule de posséder deux zones de planéité obligatoire
autour des deux doubles liaisons. En revanche, si on se limite a
cette seule forme il n'est pas obligatoire que ces deux zones de
planéité soient coplanaires entre elles.
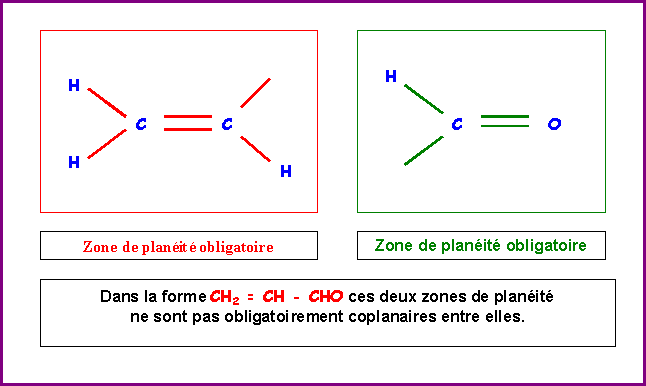
Pour expliquer la
planéité globale de la molécule, on doit faire appel a
d'autres formes mésomères pour lesquelles la double liaison est
centrale.
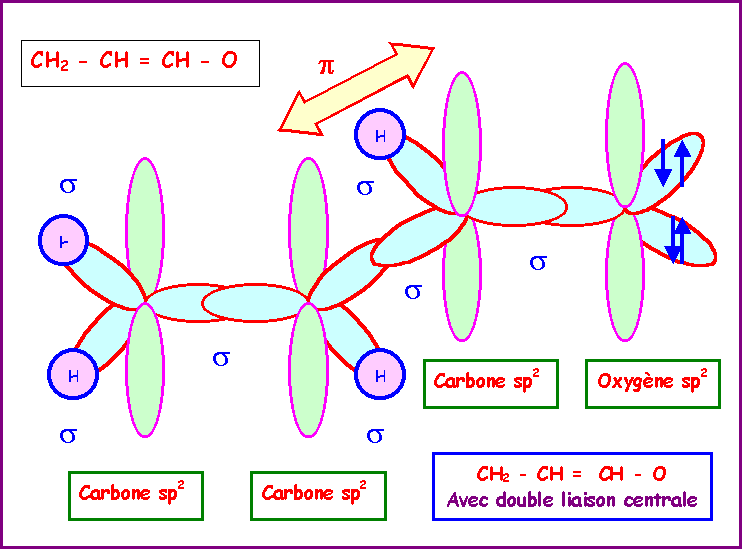
Finalement, a cause de l'effet
stabilisateur de la conjugaison la molécule adopte la
configuration pour laquelle le recouvrement des orbitales p est
maximal. Toutes les orbitales p seront donc parallèles entre
elles, toutes les orbitales sp2 seront donc
coplanaires et la molécule sera donc totalement plane.
Les orbitales p en se recouvrant
mutuellement vont donner naissance à un "nuage p" qui
englobe toute la molécule.
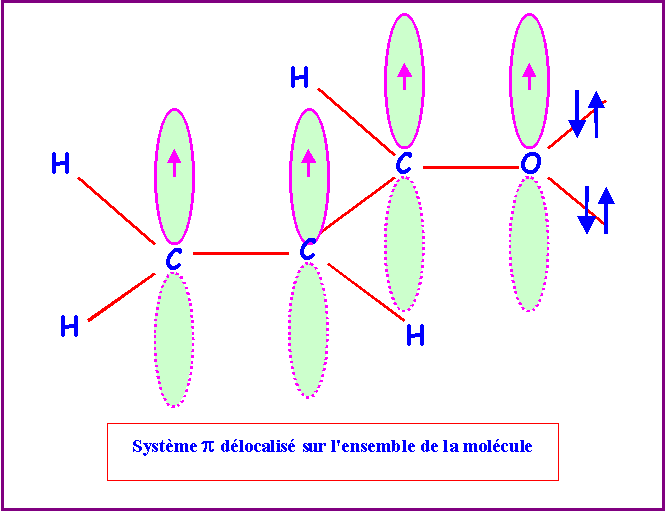
c) Que peut-on prévoir pour les longueurs
de liaison C-C ?
La molécule ne peut donc être décrite
par un schéma de Lewis unique, il s'agit en fait d'un hybride de
résonance intermédiaire entre les diverses formes limites.
Les liaisons ne sont donc ni simples ni
doubles mais intermédiaires entre les deux.
Le poids statistique de la forme principale
étant tout de même beaucoup plus important que les autres on
peut tout de même penser que la molécule réelle sera tout de
même très proche de celle-ci.
Si on utilise la formule empirique de
calcul des longueurs de liaisons on trouve :
L (A°) = 0,239 S
(n*2/Z*) + 0,164 S n* + 0,297
C : n* = 2 - Z* = 6 - (3*0,35) -
(2*0,85) = 3,25 - n*2/Z* = 4 / 3,25 = 1,231
O : n* = 2 - Z* = 8 - (5*0,35) -
(2*0,85) = 4,55 - n*2/Z* = 4 / 4,55 = 0,879
Liaison C -O simple : L = 0,239 *
(1,231+ 0,879) + 0,164 * ( 2 + 2 ) + 0,297 = 1,46 A°
Liaison C = O double L = 0,86 *
1,46 = 1,25 A°
Liaison C - C simple : L = 0,239 *
(1,231+ 1,231) + 0,164 * ( 2 + 2 ) + 0,297 = 1,54 A°
Liaison C = C double L = 0,86 *
1,54 = 1,33 A°

RETOUR
AUX ENNONCES






