
ANNEE UNIVERSITAIRE 2000-2001
DEUG SM - MASS - MIASS
TRAVAUX DIRIGES D'INITIATION A LA CHIMIE THEORIQUE
(Cours de THIERRY BRIERE)
PREMIERE PERIODE - LES ATOMES
ATOMISTIQUE (6 exercices)
SPECTRE DES HYDROGENOIDES - MODELE DE BOHR (8 exercices)
Configurations électroniques - Classification Périodique (6 exercices)
Règles de Slater - Propriétés atomiques ( 5 exercices)
mp = 1,00727 u.m.a mn = 1,00866 u.m.a me = 9,1095 10-31 kg
N = 6,022045 1023 mol-1 C = 2,998108 108ms-1
Exercice 1 :
Les masses atomiques du plomb (Z=82) et de l'hydrogène sont respectivement 207,2 et 1,008 g. Calculer le rapport des masses des électrons à celle de l'atome dans les deux cas. Conclusion ?
Exercice 2 :
Le cuivre naturel est composé de deux isotopes stables de masses atomiques respectives 62,929 et 64,927. Le numéro atomique du cuivre est Z=29.
Indiquer la composition des deux isotopes.
Sachant que la masse molaire du mélange isotopique naturel est de 63,540, calculer l'abondance des deux isotopes.
Exercice 3 :
Le chlore naturel est un mélange de deux isotopes 35Cl et 37Cl dont les proportions relatives sont respectivement en nombre d’atomes 75% et 25%.
a) Calculer la masse molaire atomique du Chlore naturel.
b) Combien de sortes de molécules de dichlore existe-t-il dans le dichlore naturel ?
c) Quelles sont leur masses molaire respectives et leur proportions relatives dans le dichlore naturel ?
Exercice 4 :
Le potassium (Z=19) existe sous forme de trois isotopes : K 39, K40 et K41 dont les masses atomiques respectives sont : 38,9637 ; 39,9640 ; 40,9618 u.m.a .
L'isotope 40 K est le plus rare, son abondance naturelle est de 0,012 %.
Sachant que la masse molaire du potassium naturel est 39,102 u.m.a, calculer les abondances naturelles des isotopes 39K et 41K dans le potassium naturel.
Calculer l'énergie de liaison du noyau de l'isotope 39 en J / mol de noyaux puis en MeV / noyau puis en MeV / nucléon.
Exercice 5 :
Calculer l'énergie de cohésion d'une mole de noyaux d'uranium (Z=92) 235 sachant que la masse du noyau est de 235,044 u.m.a.
Cet atome peut subir une réaction de fission fournissant le lantane (Z=57) 146 et le brome(Z=35) 87. Ecrire la réaction de fission. Calculer l'énergie dégagée en Joule/Kg d'uranium 235. Le pouvoir calorifique du charbon est de 33400 KJ Kg-1, quelle masse de charbon doit-on brûler pour produire l'énergie équivalente à celle de la fission d'un Kg d'uranium 235 ?
U235 = 235,044 u.m.a La146 = 145,943 u.m.a Br87 = 86,912 u.m.a
Exercice 6 :
Le Francium est le métal alcalin le plus lourd connu. Il a été découvert par Perey en 1939.
Ce métal est radioactif et ne possède aucun isotopes stables.
On obtient un de ses isotopes 223Fr par la désintégration spontanée de type a d'un isotope radioactif de l'Actinium (Z = 89). L'isotope du francium obtenu se transforme par radioactivité de type b- en un isotope du Radium.
Ces deux transformation successives sont schématisées dans la figure suivante :

On demande de déterminer les valeurs de x, y, t et u.
SPECTRE DES HYDROGENOIDES - MODELE DE BOHR
e = 1,6 10-19 C h = 6,62 10-34 Js C = 3 108 ms-1 RH = 1,09677 107 m-1
me = 9,109534 10-31 kg e0 = 8,854187 10–12 Fm-1
Exercice 1 :
Calculer pour une radiation de longueur d'onde 200 nm, sa fréquence, son nombre d'onde ainsi que l'énergie transportée par un photon de cette radiation.
Exercice 2 :
Le spectre de l'hydrogène peut se décomposer en plusieurs séries.
On se limitera ici aux cinq premières nommées respectivement série de Lyman, Balmer, Paschent, Bracket et Pfund.
a) A quels phénomènes physiques correspondent ces raies ?
b) Quelle est l'expression générale donnant la longueur d'onde d'une raie ?
c) Les raies de chaque série sont encadrées par deux raies limites nommées llim pour la limite inférieure et l1 pour la limite supérieure. A quoi correspondent ces deux limites ?
d) Etablir une formule générale permettant le calcul de ces deux limites. Calculer l1 et llim pour les 4 premières séries.
Exercice 3 :
A partir de la constante de Rydberg pour l'hydrogène calculer l'énergie d’ ionisation et celle la transition de n =2 à
n = ¥ en J et en eV. En déduire la longueur d'onde de la première raie de la série de Lyman.
Exercice 4 :
Dans l'atome d'hydrogène, l'énergie de l'électron dans son état fondamental est égale à -13,54 eV.
a) quelle est en eV, la plus petite quantité d'énergie qu'il doit absorber pour :
- passer au 1° état excité ?
- passer du premier état excité à l'état ionisé ?
b) Quelles sont les longueurs d'onde des raies du spectre d'émission correspondant au retour :
- de l'état ionisé au 1° état excité ?
- Du premier état excité à l'état fondamental ?
Exercice 5 :
Les énergies d'excitation successives de l'atome d'hydrogène ont pour valeur :
10,15 ; 12,03 ; 12,69 et 12,99 eV. L'énergie d'ionisation a pour valeur 13,54 eV. Exprimer en eV les énergies de l'électron sur les différents niveaux et montrer que ces résultats expérimentaux sont conformes à ceux obtenus à partir de l'expression théorique de l'énergie.
Exercice 6 :
Dans le cas de l'hydrogène, calculer :
a) L'énergie nécessaire pour passer de l'état fondamental au 3° état excité.
b) L'énergie nécessaire pour ioniser l'atome à partir du 3° état excité
c) La fréquence de la radiation émise quand l'atome passe du 3° au 2° état excité.
Exercice 7 :
a) Calculer l'énergie à fournir pour ioniser à partir de leur état fondamental les ions He+ ; Li2+ et Be3+.
b) Quelles sont les longueurs d'onde des raies limites de la série de Balmer pour He+ ?
Exercice 8 :
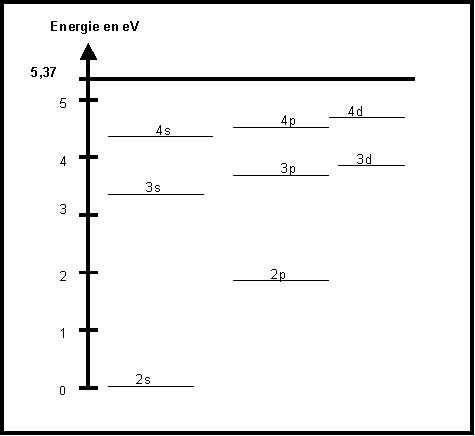
Le Lithium présente dans son spectre d’émission une raie rouge intense de longueur d’onde 671 nm. Calculer l’énergie associée à cette longueur d’onde.
La figure suivante donne les niveaux d’énergies de l’atome de Lithium déterminés à partir de son spectre d’émission.
Configurations électroniques - Nombres Quantiques - Classification périodique
Exercice 1 :
Etablir les configurations électroniques des atomes suivants. Vérifier le résultat obtenu sur une classification périodique. Justifier les éventuelles anomalies.
Ca (Z=20) - Fe(Z=26) - Br(Z=35) - Cs(Z=55) - Cr (Z=24) - Mo (Z=42) - Au (Z=79) -
Exercice 2 :
Les affirmations suivantes sont-elles exactes ou inexactes? Pourquoi ?
a) Si l=1, l’électron est dans une sous couche d.
b) Si n=4 l’électron est dans la couche O.
c) Pour un électron d, m peut être égal à 3.
d) Si l=2, la sous-couche correspondante peut recevoir au plus 6 électrons
e) Le nombre n d’un électron d’une sous-couche f peut être égal à 3.
f) Si deux " édifices atomiques " ont la même configuration électronique, il s’agit forcément du même élément.
g) Si deux " édifices atomiques " ont des configurations électroniques différentes il s’agit forcément de deux éléments différents.
Exercice 3:
Classer par ordre croissant de leur énergie les électrons d'un même atome définis par les valeurs suivantes de leurs nombres quantiques. Identifier le sous-niveau auquel ils appartiennent.
1) n = 3 ; l = 1 ; m = 0 ; s = +1/2
2) n = 4 ; l = 0 ; m = 0 ; s = -1/2
3) n = 3 ; l = 1 ; m = 0 ; s = -1/2
4) n = 3 ; l = 0 ; m = 0 ; s = +1/2
5) n = 3 ; l = 1 ; m = -1 ; s = +1/2
Exercice 4 :
Indiquez en le justifiant le nombre d'éléments présents dans les 2ème, 3ème , 4ème et 5ème périodes de la classification. Indiquez dans chaque cas le nombre d'éléments de transition.
Exercice 5 :
Un atome de numéro atomique inférieur à 20 possède un électron célibataire.
Quelles sont les diverses possibilités ?
On sait de plus que cet électron célibataire est unique. Quelles sont les diverses possibilités ?
Cet élément appartient à la période de l’argon. Quelles sont les diverses possibilités ?
Cet élément appartient au groupe du Francium (Z=87). Quel est cet élément ?
Exercice 6 :
Un composé ionique a pour formule A2B3
On sait que les éléments A et B sont tous deux des éléments des deuxième ou troisième périodes de la classification. On sait d’autre part que l’élément A est un METAL alors que B est un NON-METAL (ou METALLOÏDE).
Quelles sont les natures possibles pour ce composé ionique ?
N.B :
- On rappelle que selon la règle de Sanderson : Un élément est considéré comme métallique si le nombre total d’électron de sa couche de n le plus élevé est inférieur ou égal au numéro de la période auquel il appartient.
- On suppose que la charge d’un ion est toujours entière.
- On suppose que les ions sont les ions les plus stables de l’élément correspondant.
Approximations hydrogénoïdes de Slater - Propriétés atomiques
Exercice 1 :
En utilisant les approximations hydrogénoïdes de Slater :
a) Calculer les Z effectifs dans les cas suivants : H ; Li (3); Cl(17) ; Na(11)
b) Calculer les énergies d'ionisations successives du Béryllium (4).
puis les comparer aux valeurs expérimentales : 9,28 - 18,1 - 155 - 217 eV
c) Calculer l'énergie de première ionisation du sodium(11)
d) On donne les valeurs expérimentales des énergies de première ionisation des éléments de la 2° période EI1 exprimées en Kj mol-1
Li(3) 520 - Be(4) 899 - B(5) 800 - C(6) 1086 - N(7) 1402 - O(8) 1314 - F(9) 1678 - Ne(10) 2084 -
- Comment passe-t-on des kJmol-1 aux eV ?
- Convertir ces energies en eV.
- Tracer la courbe E.I1 = f (Z)
- Quelle est la tendance générale d’évolution de EI1 en fonction de Z ? Justifier cette tendance.
- Justifier les anomalies éventuelles par comparaison des schémas de Lewis " cases quantiques " des atomes et des ions.
Exercice 2 :
On donne pour les éléments des 1° et 2° groupes A à F les valeurs de EI1 et EI2 en eV.
Identifiez chacun de ces éléments, sachant qu’ils appartiennent aussi aux quatre premières lignes :
A : 4,3 - 31,8 B : 9,3 - 18,2 C : 6,1 - 11,9
D : 5,1 - 47,3 E : 5,4 - 75,6 F : 7,6 - 15,0
Exercice 3 :
Pour l’atome de Chlore évaluer :
a) l’énergie d’ionisation (Cl -->Cl+)
b) l’énergie de fixation électronique (Cl --->Cl-)
c) l’électronégativité dans l’échelle de Mulliken : XM = 0,21 (EI + EA)
d) le rayon de covalence : R (A°) = 0,215 (n2/Z*) + 0,145 n + 0,223
e) l’électronégativité dans l’échelle d’Alred et Rochow.
XA-R= 0,34 (Z*/R2 )+ 0,67 (R en A°)
f) Comparer les valeurs calculées aux valeurs données dans les tables.
Exercice 4 :
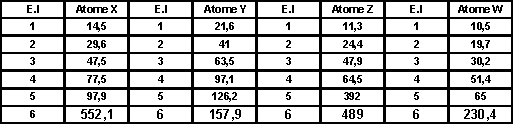
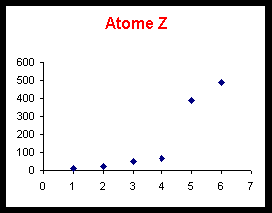
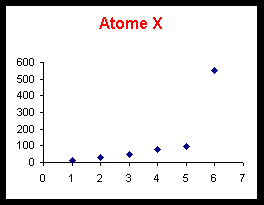
Soit 4 éléments X, Y, Z et W.
On sait que ces 4 éléments sont situés dans les 3 premières lignes de la classification périodique.
On donne les 6 premières énergies d’ionisation (en eV) de ces quatre éléments.
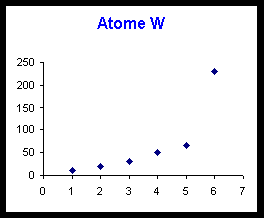
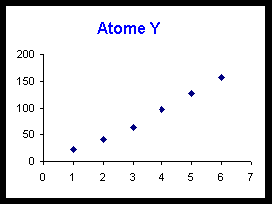
On donne d’autre part une représentation graphique de la variation de ces énergies d’ionisation.
Voir tableau et courbes pages suivantes.
1) Pour trois de ces éléments (X,Z et W) il est facile d'identifier à quelle colonne de la classification périodique ils appartiennent. Attribuer sa colonne à chacun en justifiant votre réponse.
2) Pour un de ces éléments (Y) il est difficile d'identifier la colonne. Des mesures de magnétisme permettent de déterminer que cet atome Y ne possède aucun électron célibataire. Identifiez la colonne d'appartenance de cet élément grâce à ce renseignement supplémentaire.
3) Deux de ces éléments (X et W) appartiennent à un même groupe de la classification, comment cela se traduit-il sur la représentation graphique ? Justifiez. Attribuer à ces deux atomes leur symbole et leur nom en justifiant votre réponse.
4) Elément Y : Quelles sont les diverses possibilités pour cet élément ? Pour lever l’indétermination calculer l’énergie de cinquième ionisation pour les deux possibilités et comparer les résultats obtenus à la valeur expérimentale. Conclure sur la nature de Y.
5) Elément Z : Quelles sont les diverses possibilités pour cet élément ?
Identifiez cet élément sachant que son électronégativité est de 2,5 dans l’échelle d’Alred et Rochow.
Exercice 5 :
Le tableau suivant donne : le rayon de covalence et le rayon ionique (en A°) et les énergies de première ionisation (E.I.1) et de deuxième ionisation (E.I.2) en KJ mol-1 des 4 premiers alcalins.
Rayon Covalent (A°) |
Rayon Ionique (A°) |
E.I 1 (KJ mol-1) |
E.I 2 (KJ mol-1) | |
Lithium |
1,23 |
0,60 |
520,3 |
7298 |
Sodium |
1,54 |
0,95 |
495,8 |
4562 |
Potassium |
2,03 |
1,33 |
419 |
3051 |
Rubidium |
2,16 |
1,48 |
403 |
2632 |
Dans le Chlorure de Potassium KCl la distance internucléaire K-Cl est de 3,14 A°.
Evaluer les rayons ioniques de K et de Cl.