
SPECTRE DE L'HYDROGENE ET DES HYDROGENOIDES
n = C / l = 3 108 / 200 10-9 = 1,5 1015 Hz
s = 1 / l = 1 / 200 10-9 = 5 106 m-1
E = h n = 6,62 10-34 * 1,5 1015 = 9,915 10-19 J = 6,2 eV

Passage de l’infini à n :
1 / l1 = RH (1/n2 –1/p2) = RH / n2 => l1 = n2 / RH
Passage de n + 1 à n :
1 / l2 = RH (1/n2 –1/(n+1)2) = RH [ (n + 1)2 - n2] / [n2 (n+1)2] => l2 = n2 (n + 1)2 / [ ( 2n + 1 ) RH]
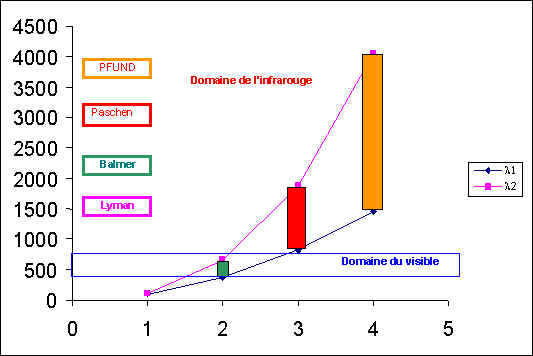
Série |
l1 ( nm) |
l2 (nm) |
Lyman (n = 1) |
91 |
122 |
Balmer ( n = 2 ) |
365 |
656 |
Paschen ( n = 3 ) |
820 |
1875 |
Pfund ( n = 4 ) |
1458 |
4051 |
Remarque :
Les séries sont de plus en plus étalées et on observe un chevauchement dès n = 4.
On finit donc pour n élevé par obtenir un spectre quasi continu.
Pour certains atomes émettant dans le visible, on pourra donc obtenir une lumière pratiquement blanche, d’où l’utilisation pour l’éclairage "au néon ".
Visible de 400 à 750 nm.
Représentation graphique.
E0 = h C RH = 6,62 10-34 * 3 108 * 1,09677 107= 2,18 10-18 J = 13,61 eV
DEn,p = En - Ep = ( -E0 / n2 ) - ( -E0 / p2 ) = E0 ( 1/p2 - 1/n2 ) avec n > p
DE¥ ,2 = E0 (1/4 - 1/¥ ) = E0 / 4 = 2,18 10-18 / 4 = 0,545 10-18 J = 3,4 eV

DEp,n = E0 (1/p2-1/n2) avec n > p
DE2,1 = E0 (1/12-1/22) = 3/4 E0 = 3/4 * 13,54 = 10,155 eV = 1,62 10-18 J
DE¥ ,2 = E0 (1/22-1/¥ 2) = 1/4 E0 = 1/4 * 13,54 = 3,38 eV = 5,4 10-19 J
DE = h n Û n = DE / h = C / l Û l = h C / DE
l ¥ ,2 = h C / DE¥ ,2 = 6,62 10-34 * 3 108 / 5,4 10-19 = 3,678 10-7 m = 367,8 nm
l 2,1 = h C / DE2,1 = 6,62 10-34 * 3 108 / 1,62 10-18 = 1,226 10-7 m = 122,6 nm
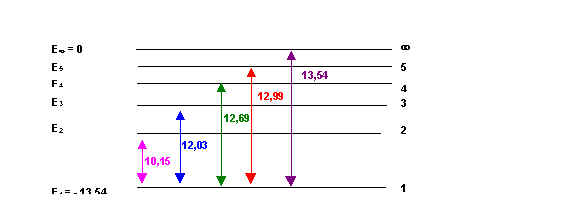
E2 - E1 = 10,15 Þ E2 = 10,15 + E1 = 10,15 - 13,54 = -3,39 ev
E3 - E1 = 12,03 Þ E3 = 12,03 + E1 = 12,03 - 13,54 = -1,51 ev
E4 - E1 = 12,69 Þ E4 = 12,69 + E1 = 12,69 - 13,54 = -0,85 ev
E5 - E1 = 12,99 Þ E5 = 12,99 + E1 = 12,99 - 13,54 = -0,55 ev
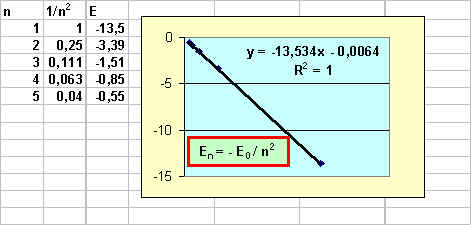
La vérification del'accord entre valeurs expérimentale et théorie peut se faire par simple calcul de E0/n2.
On peut aussi tracer En en fonction de 1/n2 et vérifier qu'on obtient une droite de pente -E0 et d'ordonnée à l'origine nulle.
a) DE4,1 = E4 - E1 = ( -E0 / 16 ) + E0 = 15 / 16 E0 = 12,75 eV
b) DE¥ ,4 = E¥ - E4 =0 - -E0 / 16 = 1 / 16 E0 = 0,85 eV
c) DE4,3 = E4 - E3 = ( -E0 / 16) + ( E0 / 9 ) = E0 ( 1/9 - 1/16 )= 0,661 eV = 1,06 10-19 J
n4,3 = DE4,3 / h = 1,06 10-19 / 6,62 10-34 = 1,6 1014 Hz
Atomes hydrogénoïdes : En = - E0 * [ Z2 / n2 ]
He+ : Z = 2 Þ En = - E0 * [ 22 / n2 ] = - 4 E0 / n2 = - 54,4 / n2
E.I He+ = 54,4 eV
Li2+ : Z = 3 Þ En = - E0 * [ 32 / n2 ] = - 9 E0 / n2 = - 122,4 / n2
E.I Li2+ = 122,4 eV
Be3+ : Z = 4 Þ En = - E0 * [ 42 / n2 ] = - 16 E0 / n2 = - 217,6 / n2
E.I Be3+ = 217,6 eV
b) Balmer : retour à n = 2
DE3,2 = E3 - E2 = - 54,4 / 22 + 54,4 / 32 = 54,4 (1/4 - 1/9) = 7,556 eV = 1,21 10-8 J
l = h c / DE = 164,3 nm
DE¥ ,2 = E¥ - E2 = - 54,4 / 4 = 13,6 eV = 2,18 10-18 J
l = h c / DE = 91,3 nm