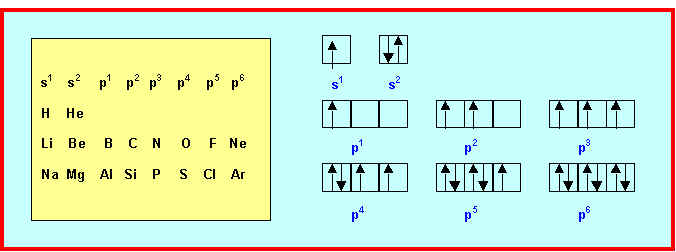
Configurations électroniques – Nombres quantiques
Classification Périodique des Eléments
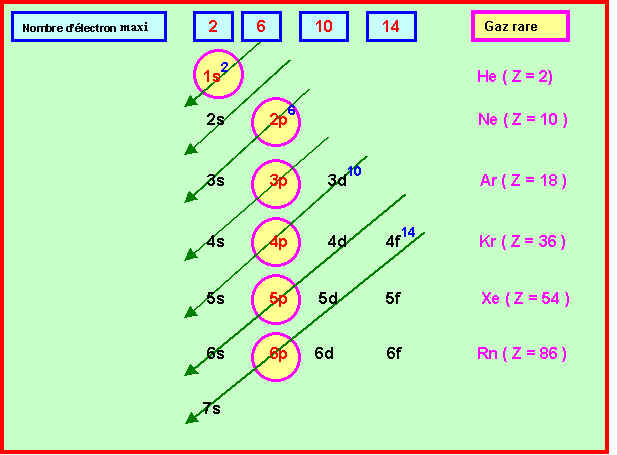
Règle de Klechkowski :
A quelques exceptions près, le remplissage des couches et des sous-couches se fait dans l’ordre des valeurs de ( n + l ) croissant. Si plusieurs combinaisons possibles conduisent à la même valeur, on choisit celle possédant la plus petite valeur de n .
Soit la représentation mnémotechnique suivante :

Les configurations électroniques seront notées sous la forme abrégée
(gaz rare) (couches externes)
La couche de valence est écrite en rouge, les couches de cœur en vert.
Si une sous-couche interne n’est pas totalement remplie on la compte dans la couche de valence car elle peut participer aux propriétés chimiques.
Calcium (Ca) : Z = 20 = 18 + 2 à ( Ar ) 4s2
Fer (Fe) : Z = 26 26 = 18 + 8 à ( Ar ) 4s2 3d6 ( Ar ) 3d6 4s2
Brome (Br) : Z = 35 = 18 + 17 à ( Ar ) 4s2 3d10 4p5 ( Ar ) 3d10 4s2 4p5
Césium (Cs) : Z = 55 = 54 + 1 à ( Xe ) 5s1 ( Xe ) 5s1
Chrome (Cr) : Z = 24 = 18 + 6 à ( Ar ) 4s2 3d4 ( Ar ) 3d4 4s2
Molybdène (Mo) : Z = 42 = 36 + 6 à ( Kr ) 5s2 4d4 ( Kr ) 4d4 5s2
Or (Au) : Z = 79 = 54 + 25 à ( Xe ) 6s2 4f14 5d9 ( Xe ) 4f14 5d9 6s2
Comparaison avec les configurations électroniques réelles :
La règle de Klechkowski ne permet pas d’obtenir à coup sur la configuration électronique réelle des atomes. A partir de n = 3 de nombreuses exceptions à cette règle apparaissent. Nous ne chercherons pas à justifier toutes ces exceptions mais on peut expliquer certaines d’entre elles en admettant qu’une sous-couche totalement remplie ou à demi-remplie apporte une stabilité supplémentaire.
Ainsi la configuration d5 s1 est-elle plus stable que la configuration d6 s2 ( Cr et Mo)
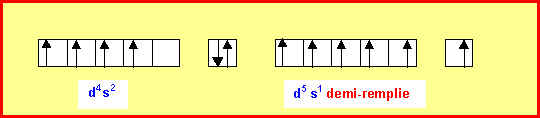
De même la configuration d10 s1 est plus stable que la configuration d9 s2 ( Au )
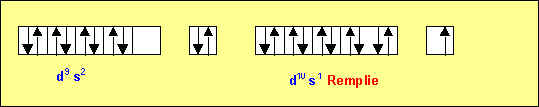
Les configurations réelles de ces trois éléments sont donc :
Cr : ( Ar ) 3d5 4s1 Mo : ( Kr ) 4d5 5s1 Au : ( Xe ) 4f14 5d10 6s1
Nous admettrons cette règle et l’appliquerons quand ces cas semblables se présenteront.
Nous rencontrerons des situations analogues lors de l’étude des énergies de première ionisation et pour expliquer la formation de certains ions.
Remarque : Si la configuration est modifiée la position dans la classification périodique ne l’est pas.
Rappel des règles concernant les 4 nombres quantiques :
n : nombre quantique principal avec n entier non nul n = 1, 2, 3 ….
l : nombre quantique secondaire (ou azimutal) avec l compris entre 0 et n –1
ml (ou m) : nombre quantique magnétique avec ml compris entre – l et + l
ms (ou s) : nombre quantique de spin avec ms = 1/2 ou ms = - 1/2
n : couche
l : sous-couche
m : case quantique
Les valeurs de n sont codifiées par des lettres majuscules :
n = 1 à K ; n = 2 à L ; n = 3 à M ; n = 4 à N ; n = 5 à O …
Les valeurs de l sont codifiées par des lettres minuscules :
l = 0 à s ; l = 1 à p ; l = 2 à d ; l = 3 à f ; l = 4 à g …
a) l = 1 à p : FAUX
b) n = 4 à N : FAUX
c) d à l = 2 à ml = -2, -1, 0, 1, 2 : FAUX
d) l = 2 à ml = -2, -1, 0, 1, 2 à 5 cases quantiques à 10 électrons maximum : FAUX
e) n = 3 à l = 0, 1, 2 (s,p,d) à pas de f sur couche 3 : FAUX
f) " édifice atomique " = atome " neutre " ou ion
Un ion a la même configuration électronique qu’un atome neutre d’un autre élément : FAUX
Exemples : Na+ , Ne et O2- ont la même configuration électronique.
g) L’ion et l’atome neutre du même élément ont forcement des configurations électroniques différentes : FAUX
Electron 1 : n = 3 ; l = 1 (è 3 p ) ; m = 0 ; s = +1/2
Electron 2 : n = 4 ; l = 0 (è 4 s ) ; m = 0 ; s = -1/2
Electron 3 : n = 3 ; l = 1 (è 3 p ) ; m = 0 ; s = -1/2
Electron 4 : n = 3 ; l = 0 (è 3 s ) ; m = 0 ; s = +1/2
Electron 5 : n = 3 ; l = 1 (è 3 p ) ; m = -1 ; s = +1/2
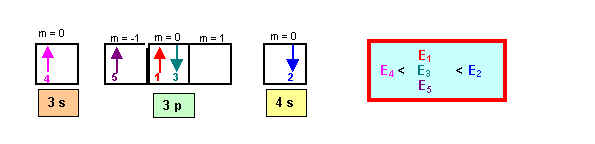
Les énergies des sous-couches sont dans l'ordre 3 s < 3 p < 4 s
Les 3 électrons appartenant à la même sous-couche 3 p ont la même énergie.
La classification périodique reproduit fidèlement la règle de Klechkowski.

Ligne 1 : n = 1 à 2 n2 = 2 (1 s2) à 2 éléments
Ligne 2 : n = 2 à 2 n2 = 8 (2s2 2p6) à 8 éléments
Ligne 3 : n = 3 à 2 n2 = 18 (3s2 3p6 3d10) à 18 éléments prévus mais selon Klechkowski le niveau 3d ne se remplit qu’après le niveau 4s ; ce niveau sera donc placé dans la quatrième ligne et finalement, il n’y aura que 8 éléments dans la troisième ligne. Les éléments de transitions correspondent aux blocs d et f. Ici 10 éléments de transition (3d10).
Ligne 4 : n = 4 à 2 n2 = 32 (4s2 4p6 4d10 4f14) à 32 éléments prévus mais selon Klechkowski le niveau 4d ne se remplit qu’après le niveau 5s ; ce niveau sera donc placé dans la cinquième ligne, de même le niveau 4f ne se remplit qu’après le niveau 6s ; ce niveau sera donc placé dans la sixième ligne. Il devrait donc y avoir 8 éléments dans la quatrième ligne mais n’oublions pas d’ajouter les éléments correspondant au niveau 3d. Finalement, il y aura 18 éléments dans la quatrième ligne, dont 10 de transition.
Un raisonnement analogue conduit à placer 18 éléments dans la cinquième ligne, dont 10 de transition.
On peut retrouver plus simplement ce principe de construction en considérant que dans la représentation de la règle de Klechkowski une ligne démarre toujours par ns et se termine par np.
La ligne 6 démarre donc avec 6s et se termine avec 6p. On retrouve donc 6s2, 4f14, 5d10, 6p6
Soit finalement la représentation traditionnelle :
1s |
|||||||||||||||||
2s |
2p |
||||||||||||||||
3s |
3p |
||||||||||||||||
4s |
3d |
4p |
|||||||||||||||
5s |
4d |
5p |
|||||||||||||||
6s |
5d |
6p |
|||||||||||||||
7s |
6d |
4f |
|||||||||||||
5f |
L’élément en question appartient à l’une des trois premières lignes de la classification.
a) les configurations possibles sont : s1 ; p1 ; p2 ; p3 ; p4 ; p5 qui toutes possèdent un électron célibataire. Les éléments possibles sont donc : H ; Li ; Na ; B ; Al ; C ; Si ; N ; P ; O ; S ; F ; Cl
b) Les configurations à un seul électron célibataire sont : s1 ; p1 ; p5 soient les éléments : H ; Li ; Na ; B ; Al ; F ; Cl.
Na ; Al et Cl appartiennent a la période de l'Argon.
Fr : Z = 87 est un alcalin l'élément cherché est donc Na.