Approximations hydrogénoïdes de Slater – Propriétés atomiques
a) Si rien n'est précisé, on supposera toujours que le Z* cherché est celui d'un électron appartenant à la couche de valence de l'atome considéré.
H : Z* = 1
Li : [1s2] [2s1] Þ Z*2s = 3 - ( 2 * 0,85 ) = 1,3
Cl : [1s2] , [2s2 , 2p6 ] , [3s2 , 3p5] Þ Z*3s3p= 17 - ( 6 * 0,35 ) - ( 8 * 0,85 ) - ( 2 * 1 ) = 6,1
Na : [1s2] , [2s2 , 2p6 ] , [3s1] Þ Z*3s = 11 - ( 8 * 0,85 ) - ( 2 * 1 ) = 2,2
b)
Be |
[1s2] |
[2s2] |
||
E1 |
E2 |
EBe = 2 E1 + 2 E2 |
||
Be+ |
[1s2] |
[2s1] |
||
E1 |
E'2 |
EBe+ = 2 E1 + E'2 |
||
E.I1 = EBe+ - EBe = E'2 - 2 E2 |
||||
Be2+ |
[1s2] |
|||
E1 |
EBe2+ = 2 E1 |
|||
E.I2 = EBe2+ - EBe+ = -E'2 |
||||
Be3+ |
[1s1] |
|||
E'1 |
EBe3+ = E'1 |
|||
E.I3 = EBe3+ - EBe2+ = E'1 - 2 E1 |
||||
Be4+ |
EBe4+ = 0 |
|||
E.I4 = EBe4+ - EBe3+ = -E'1 |
Calcul des diverses énergies :
Z*E2 = 4 - 0,35 - (2 * 0,85 ) = 1,95
E2 = -13,6 * 1,952/22 = -12,92 eV
Z*E'2 = 4 - (2 * 0,85 ) = 1,95 + 0,35 = 2,3
E'2 = -13,6 * 2,32/22 = -17,99 eV
Z*E1 = 4 - 0,3 = 3,7
E1 = -13,6 * 3,72/12 = -186,18 eV
Z*E'1 = 4
E'1 = -13,6 * 42/12 = -217,6 eV
Calcul des énergies d'ionisation successives :
E.I1 = EBe+ - EBe = E'2 - 2 E2 = -17,99 - ( 2 * -12,92 ) = 7,85 eV
E.I2 = EBe2+ - EBe+ = -E'2 = 17,99 eV
E.I3 = EBe3+ - EBe2+ = E'1 - 2 E1 = -217,6 - ( 2 * -186,18 ) = 154,76 eV
E.I4 = EBe4+ - EBe3+ = -E'1 = 217,6 eV
Comparaison avec les valeurs expérimentales :
| E.I calculé | E.I expérimental | Ecart ( % ) | ||
| E.I1 | Be à Be+ + 1 e- | 7,85 eV | 9,28 eV | 15,4 |
| E.I2 | Be+ à Be2+ + 1 e- | 17,99 eV | 18,1 eV | -0,6 % |
| E.I3 | Be2+ à Be3+ + 1 e- | 154,76 eV | 155 eV | -0,15 % |
| E.I4 | Be3+ à Be4+ + 1 e- | 217,6 eV | 217 eV | 0,3 % |
On voit que l'accord entre valeurs calculées et expérimentales est excellent sauf pour la première énergie d'ionisation. Ce résultat est général, les valeurs calculées par ce modèle simple sont en bon accord avec les valeurs expérimentales, l'écart observé est généralement plus important pour la première énergie d'ionisation. (Les valeurs des énergies d’ionisation augmentant régulièrement (effet d’écran diminué par l’arrachement des électrons, l’erreur commise devient rapidement négligeable.)
Ce mauvais accord est justifiable par la règle de la couche remplie ou 1/2 remplie.

Be possédant une couche remplie est fortement stabilisé.
Be+ qui ne possède qu'une couche 1/2 remplie est moins bien stabilisé.
Le passage de Be à Be+ est donc difficile et la première énergie d'ionisation de Be est anormalement élevée ce qui justifie que la valeur calculée qui ne tient pas compte de cet effet soit trop faible par rapport à la réalité.
Le même effet devrait se manifester pour les autres ionisations impliquant des couches remplies ou 1/2 remplies mais les valeurs de ces énergies étant très élevées, cet effet devient négligeable.
c) Na à Na+ + 1 e-
E.I1 = ENa+ - ENa
Na : [1s2] , [ 2s2 , 2p6 ] , [ 3s1 ]
Na : [ E1 ] , [ E2 ] , [ E3 ]
ENa = 2 E1 + 8 E2 + E3
Na+ : [1s2] , [2s2 , 2p6 ]
Na+ : [ E1 ] , [ E2 ]
ENa = 2 E1 + 8 E2
E.I1 = ENa+ - ENa = - E3
Na : [1s2] , [2s2 , 2p6 ] , [3s1] Þ Z*3s = 11 - ( 8 * 0,85 ) - ( 2 * 1 ) = 2,2
E3 = -13,6 * 2,22 / 9 = -7,3 eV
E.I1 = 7,3 eV
La valeur expérimentale est de 5,1 eV seulement.
Comme précédemment, cet écart est justifiable par comparaison des schémas de Lewis de Na et Na+.
Na+ ayant la structure d'un gaz rare (2s2, 2p6) est très stable.
Il sera donc très facile d'ioniser Na et la valeur expérimentale est particulièrement basse.
d)
KJ / mole * 1000 / N / e à eV / atome
N * e = F = 96500 C
Kj mol-1 / 96,5 à eV/atome
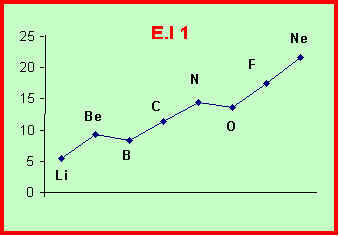
Li : 5,4 eV -Be : 9,3 eV - B : 8,3 eV -C : 11,3 eV - N : 14,5 eV -O : 13,6 eV -F : 17,4 eV - Ne : 21,6 eV
Rappelons la règle vue précédemment : " une couche ou sous-couche à demi remplie ou complètement remplie apporte une stabilité supplémentaire ".
Si cette règle est respectée, les atomes ayant une couche de ce type seront très stables et donc difficiles à ioniser puisqu’on perd alors cette stabilité supplémentaire ; leur énergie d’ionisation sera alors "anormalement élevée ".
Les atomes de ce type sont Be, N et Ne et on trouve effectivement que la valeur expérimentale de l’énergie d’ionisation est plus élevée que sa valeur calculée.
Inversement les ions possédant une couche remplie ou demi-remplie seront très stables et l’atome correspondant aura donc une énergie d’ionisation "anormalement faible ".
Les atomes de ce type sont B et O et on trouve effectivement que la valeur expérimentale de l’énergie d’ionisation est plus faible que sa valeur calculée.
Le carbone n’appartient à aucune de ces catégories et son énergie d’ionisation calculée est très proche de la valeur expérimentale.
Le Lithium est un cas particulier, sa couche de valence 1s1 le placerait à la limite dans la première catégorie, mais l’ion formé possède une couche totalement remplie (1s2). C’est cet effet qui l’emporte et on trouve que la valeur expérimentale de l’énergie d’ionisation est plus faible que sa valeur calculée.
Reste enfin le cas de l’atome de Fluor qui comme le carbone devrait conduire à des valeurs calculée et expérimentale proches. Ce n’est pas le cas, et la valeur expérimentale est beaucoup plus élevée que la valeur calculée. Le fort écart observé pour cet atome traduit la difficulté d’arracher des électrons alors qu’il suffirait d’en ajouter un pour atteindre la structure de gaz rare. C’est une manifestation de la règle de l’octet. Enfin, cela traduit aussi la forte électronégativité de l’atome de Fluor qui retient fortement les électrons.
On sait que les éléments considérés appartiennent aux 4 premières lignes et au deux premiers groupes. H est exclu puisqu'il ne possède qu'un électron et n'a donc qu'une seule énergie d'ionisation.

Le groupe auquel appartient un élément est identifiable par le saut observé dans les valeurs des énergies d'ionisation successives. Ce saut correspond a l'ion possédant la structure électronique d'un gaz rare.
Pour trouver ce saut il suffit ici de comparer les valeurs de EI1 et EI2.
On voit que pour les éléments B, C et F la valeur de E.I1 est environ deux fois plus élevée que celle de E.I1. Pour les éléments A , D et E ce rapport est beaucoup plus élevé.
A, D et E appartiennent donc au groupe 1 (E.I2 très élevé)
B, C et F appartiennent au groupe 2.
Pour identifier la période de chacun il suffit de comparer les valeurs de E.I1
E.I dans un même groupe augmente de bas en haut (sens inverse du rayon atomique) et l'élément de plus grande énergie d'ionisation est donc situé le plus haut.
A = K ; D = Na ; E = Li
B = Be ; C = Mg ; F = Ca
Cl : Z = 17 1s2, 2s2, 2p6, 3s2, 3p5

ECl = 2 E1 + 8 E2 + 7 E3 ECl+ = 2 E1 + 8 E2 + 6 E’3 ECl- = 2 E1 + 8 E2 + 8 E’3
Cl à Cl+ + e- E.I = ECl+ - ECl = 6 E’3 – 7 E3 ( E.I = énergie d’ionisation )
Cl + e- à Cl- Efe = ECl- - ECl = 8 E’’3 – 7 E3 ( Efe = énergie de fixation électronique)
Z*Cl = 17 – ( 6 * 0,35 ) – ( 8 * 0,85 ) – 2 = 6,1
Z*Cl+ = Z*Cl + 0,35 = 6,45
Z*Cl- = Z*Cl - 0,35 = 5,75
E3 = -13,6 * 6,12 / 9 = -56,22 eV
E’3 = -13,6 * 6,452 / 9 = -62,87 eV
E’’3 = -13,6 * 5,752 / 9 = -49,96 eV
E.I = ( 6 * - 62,87 ) – ( 7 * -56,22 ) = 16,3 eV ENDOTHERMIQUE - DIFFICILE
Efe = ( 8 * - 49,96 ) – ( 7 * -56,22 ) = -6,1 eV EXOTHERMIQUE – FACILE
XM = 0,21 * ( 16,3 + 6,1 ) = 4,7
RCl = ( 0,215 * 9 / 6,1) + ( 0,148 * 3 ) + 0,223 = 0,984 A°
XAR = (0,34 * 6,1 / 0,9842) + 0,67 = 2,81
Valeur Calculée |
Valeur Tabulée |
|
E.I |
16,3 |
13 |
E.A |
6,1 |
3,62 |
XM |
4,7 |
3,5 |
R |
0,984 |
0,99 |
XAR |
2,81 |
2,8 |
Conclusions :
L’utilisation des règles de Slater permet d’évaluer simplement l’ordre de grandeur de certaines propriétés atomiques.
L’énergie d’ionisation est mieux évaluée que l’affinité électronique. L’écart entre valeur calculée et valeur expérimentale est toutefois assez grand. On n’obtient que l’ordre de grandeur de celles-ci. On peut toutefois tirer des conclusions qualitatives intéressantes. Ici on voit bien que l’ionisation "spontanée " de Cl donne Cl- (processus exothermique libérant de l’énergie) et non Cl+ (processus endothermique nécessitant un apport d’énergie) ce qui est tout à fait conforme à l’expérience.
L’électronégativité de Mulliken est assez mal évaluée en raison des erreurs sur EI et EA mais on voit tout de même que Cl est un atome fortement électronégatif.
Le rayon atomique est par contre évalué très correctement par la formule donnée (voir exercice suivant). L’électronégativité d’Alred et Rochow basée sur la valeur de R est en conséquence très correctement évaluée elle aussi.
Z* |
n |
n2/Z* |
R Calculé |
R expérimental |
|
F |
5,2 |
2 |
0,77 |
0,69 |
0,72 |
O |
4,55 |
2 |
0,88 |
0,71 |
0,73 |
S |
5,45 |
3 |
1,65 |
1,02 |
1,02 |
Be |
1,95 |
2 |
2,05 |
0,96 |
0,90 |
Si |
4,15 |
3 |
2,17 |
1,13 |
1,11 |
Mg |
2,85 |
3 |
3,16 |
1,35 |
1,36 |
Classements
- par valeurs de n2/Z* : F < O < S < Be < Si < Mg
On constate que la valeur de n2/Z* permet un classement qualitatif des atomes, malgré une inversion (S et Be).
La formule R = 0,215 n2/Z* + 0,148 n + 0,225 permet un calcul assez précis des valeurs des rayons de covalence et un bon accord avec les valeurs expérimentales.
Affectons l’anion de l’indice A et le cation de l’indice C.
d = RC + RA
RC = k nC2 / Z*C
RA = k nA2 / Z*A
RC / RA = ( nC2 / nA 2 ) ( Z*A / Z*C )
RC = ( nC2 / nA 2 ) * ( Z*A / Z*C ) * RA = K RA
D = ( K + 1 ) RA
RA = d / ( K + 1 )
RC = K RA
NaF : d = 2,31 A° ; Z*C = 6,85 ; Z*A = 4,85 ; nC = 2 ; nA = 2
K = 4,85 / 6,85 = 0,708 ; RA = 2,31 / 1,708 = 1,35 A° ; RC = 0,708 * 1,35 = 0,96 A°
RF- = 1,35 A° ; RNa+ = 0,96 A°
LiF : d = 2,01 A° ; Z*C = 2,70 ; Z*A = 4,85 ; nC = 1 ; nA = 2
K = (4,85 / 6,85) * (1 / 4) = 0,449 ; RA = 2,01 / 1,449 = 1,39 A° ; RC = 0,449 * 1,39 = 0,62 A°
RF- = 1,39 A° ; RLi+ = 0,62 A°
Les valeurs trouvées pour RF- ne sont pas tout à fait identiques mais sont tout de même très proches.
Cette méthode très simple permet donc d’évaluer de proche en proche les valeurs des différents rayons ioniques. Une valeur moyenne sera retenue à partir de déterminations sur plusieurs solides ioniques différents. Ces valeurs des rayons ioniques de Pauling ont été tabulées et sont largement utilisées en cristallographie.
D’autres tables plus modernes existent, telle que la table de Schanon et Prewitt qui ont corrélés les distances internucléaires de plus de mille oxydes. En pratiques les différences sont faibles entre les diverses tables et la table de Pauling est encore très utilisée actuellement.
Elément X : le saut se produit pour la quatrième ionisation. X3+ possède la structure d’un gaz rare et X appartient à la colonne 13 de la classification : X = B ou Al.
Eléments Y et Z : le saut se produit pour la cinquième ionisation. X4+ et Z4+ possèdent la structure d’un gaz rare et X et Z appartiennent à la colonne 14 de la classification : Y et Z = C ou Si.
Elément W : le saut se produit pour la deuxième ionisation. X+ possède la structure d’un gaz rare et X appartient à la colonne 1 de la classification : W = Li ou Na.
3) Les atomes Y et Z appartiennent à la même colonne. Cela se traduit par une grande similitude des courbes (parallélisme évident).
L’énergie de première ionisation varie en sens inverse du rayon atomique.
Plus l’atome est petit, plus l’électron est près du noyau et plus il est difficile à arracher.
Le rayon atomique variant sensiblement comme n2/Z* augmente quand on descend dans une colonne car l’augmentation de n2 l’emporte largement sur celle de Z*.
L’élément ayant l’énergie de première ionisation la plus élevée est donc l’élément situé le plus haut.
Y est le carbone et Z le silicium.
5) Il ne reste qu’à identifier X qui peut être B ou Al.
La méthode la plus rapide pour déterminer la nature de X consiste à calculer une énergie d'ionisation de B et de Al et de comparer la valeur obtenue avec la valeur expérimentale.
Plutôt que d'utiliser les règles de Slater, il peut être intéressant si cela est possible d'utiliser le modèle de Bohr pour les atomes hydrogénoïdes.
Dans le cas qui nous intéresse ici les ions hydrogénoides des atomes concernés sont B4+ ou Al12+.
Les ionisations à considérer sont donc :
B4+ à B5+ + 1 e- (cinquième énergie d'ionisation de B)
et/ou
Al12+ à Al13+ + e- (treizième énergie d'ionisation de Al)
Puisque nous connaissons l'énergie de cinquième ionisation de X (338,5 eV), c'est cette énergie d'ionisation que nous allons calculer pour le Bore par application directe du modèle de Bohr.
Soit (voir le modèle de Bohr) E.IB4+ = Z2 * E0 = 25 * 13,6 = 340 eV
La valeur calculée étant en très bon accord avec la valeur expérimentale, il est quasiment certain que X est bien l'atome de Bore.
Cette méthode n'étant toutefois pas toujours applicable, nous allons tout de même calculer les trois premières énergies d’ionisation de B par application des règles de Slater:

EB = 2 E1 + 3 E2 EB+ = 2 E1 + 2 E’2 EB2+ = 2 E1 + E’’2 EB3+ = 2 E1
Energie de première ionisation : B à B+ + 1 e- E.I.1 = EB+ - EB = 2 E’2 – 3 E2
Energie de deuxième ionisation : B+ à B2+ + 1 e- E.I.2 = EB2+ - EB+ = E’’2 – 2 E’2
Energie de troisième ionisation : B2+ à B3+ + 1 e- E.I.3 = EB3+ - EB2+ = - E’’2
E2 = -13,6 * Z*E22 / 4 E’2 = -13,6 * Z*E’22 / 4 E’’2 = -13,6 * Z*E’’22 / 4
Z*E2 = Z*B = 5 – ( 2 * 0,35 ) – ( 2 * 0,85 ) = 2,6
Z*E’2 = Z*B+ = 2,6 + 0,35 = 2,95
Z*E’’2 = Z*B2+ = 2,95 + 0,35 = 3,3
E2 = -13,6 * 2,62 / 4 = -22,98 eV
E’2 = -13,6 * 2,952 / 4 = -29,58 eV
E’’2 = -13,6 * 3,32 / 4 = -37,03 eV
E.I.1 = 2 E’2 – 3 E2 = ( 2 * -29,58 ) – ( 3 * - 22,98 ) = 9,8 eV
E.I.2 = E’’2 – 2 E’2 = -37,03 – ( 2 * -29,58 ) = 22,1eV
E.I.3 = - E’’2 = 37,0 eV
Calculé pour B |
Expérimental pour X |
Ecart % |
|
E.I.1 |
9,8 |
8,26 |
18,6 |
E.I.2 |
22,1 |
25 |
-11,6 |
E.I.3 |
37,0 |
37,8 |
-2,1 |
L’examen du tableau montre que les valeurs calculées pour le Bore s’accordent assez bien avec celles données pour l’atome X. On peut donc bien supposer que X est le Bore.
A titre de vérification, calculons les trois premières énergies d’ionisation de Al :

EAl = 2 E1 + 8 E2 + 3 E3
EAl+ = 2 E1 + 8 E2 + 2 E’3
EAl2+ = 2 E1 + 8 E2 + E’’3
EAl3+ = 2 E1 + 8 E2
Energie de première ionisation : Al à Al+ + 1 e- E.I.1 = EAl+ - EAl = 2 E’3 – 3 E3
Energie de deuxième ionisation : Al+ à Al2+ + 1 e- E.I.2 = EAl2+ - EAl+ = E’’3 – 2 E’3
Energie de troisième ionisation : Al2+ à Al3+ + 1 e- E.I.3 = EAl3+ - EAl2+ = - E’’3
E3 = -13,6 * Z*E32 / 4 E’3 = -13,6 * Z*E’32 / 4 E’’3 = -13,6 * Z*E’’32 / 4
Z*E3 = Z*Al = 13 – ( 2 * 0,35 ) – ( 8 * 0,85 ) – ( 2 * 1 ) = 3,5
Z*E’3 = Z*Al+ = 3,5 + 0,35 = 3,85
Z*E’’3 = Z*Al2+ = 3,85 + 0,35 = 4.2
E3 = -13,6 * 3,52 / 9 = -18,51 eV
E’3 = -13,6 * 3,852 / 9 = -22,40 eV
E’’3 = -13,6 * 4,22 / 9 = -26,66 eV
E.I.1 = 2 E’3 – 3 E3 = ( 2 * -22,40 ) – ( 3 * -18,51 ) = 10,7 eV
E.I.2 = E’’3 – 2 E’3 = -26,66 – ( 2 * -22,40 ) = 18,1 eV
E.I.3 = - E’’3 = 26,7 eV
Expérimental pour X |
Calculé pour Al |
Expérimental pour Al | Ecart % |
|
E.I.1 |
8,26 |
10,7 |
6,0 |
78 |
E.I.2 |
25 |
18,1 |
18,8 |
-3,7 |
E.I.3 |
71,3 |
26,7 |
28,5 |
-6,3 |
L’examen du tableau montre que les valeurs calculées pour l’Aluminium ne s’accordent aucunement avec les données concernant l’atome X. L’atome X n’est donc pas l’Aluminium mais bien le Bore comme nous l’avions trouvé précédemment.
En revanche les valeurs calculées pour E.I2 et E.I3 s’accordent assez bien avec les valeurs expérimentales (colonne 4), ce qui confirme l’intérêt des règles de Slater. L’écart énorme trouvé pour E.I1 peut s’expliquer par les configurations électroniques de Al et Al+.
Al+ possédant une couche complètement remplie est stabilisé, il est donc formé facilement et E.I 1 est "anormalement " faible.