Corrigé des Exercices sur l'OXYDO-REDUCTION
Pour tous les exercices
sauf indication contraire, le pH sera considéré comme constant et égal à 0. On
prendra 2,3 RT/F = 0,06.
DONNEES
|
Oxydant |
Fe3+ |
CH3COOH |
Br2 |
IO3- |
S4O62- |
O2 |
MnO4- |
|
Réducteur |
Fe2+ |
CH3CH2OH |
Br- |
I2 |
S2O32- |
H2O2 |
Mn2+ |
|
E0 (V) |
0,77 |
0,1 |
1,07 |
1,19 |
0,09 |
0,69 |
1,51 |
|
Oxydant |
Cr2O72- |
I2 |
Br2 |
HNO3 |
Sn4+ |
Ce4+ |
Cr3+ |
|
|
Réducteur |
Cr3+ |
I- |
Br- |
NO |
Sn2+ |
Ce3+ |
Cr2+ |
|
|
E0 (V) |
1,33 |
0,54 |
1,07 |
0,96 |
0,14 |
1,61 |
-0,41 |
|
Exercice 1 :
1) Equilibrer les réactions se produisant
entre les couples :
a) HNO3/NO
et Fe3+/Fe
b) IO3-/I2
et CH3COOH/CH3CH2OH
c) Br2/Br-
et S4O62- / S2O32-
2) Dans chaque cas calculer la constante
d'équilibre de la réaction spontannée dans les conditions standards.
a) HNO3/NO
et Fe3+/Fe
HNO3
+ 3 H+ + 3 e- = NO + 2 H2O E01
= 0,96 V Couple Oxydant
Fe = Fe3+ + 3e- E02
= 0,77 V Couple Réducteur
HNO3
+ 3 H+ + Fe = NO + 2 H2O + Fe3+
Log KR = 3 * (0,96 -
0,77) / 0,06 = 9,5 - KR = 109,5 - réaction quasi totale
b) IO3-/I2
et CH3COOH/CH3CH2OH
2 * [ 2 IO3- + 12 H+ +
10 e- = I2 + 6 H2O E01 =
1,19 V Couple Oxydant
5 * [CH3CH2OH + H2O = CH3COOH
+ 4 H+ + 4 e- E02 = 0,10 V Couple
Réducteur
4 IO3-
+ 24 H+ + 5 CH3CH2OH + 5 H2O
= 2 I2 + 12 H2O + 5 CH3COOH + 20 H+
4 IO3-
+ 4 H+ + 5 CH3CH2OH = 2 I2
+ 7 H2O + 5 CH3COOH
log KR = 10 * 4 * (1,19 -
0,10 ) / 0,06 = 60 - KR=1060 - Réaction quasi totale
c) Br2/Br-
et S4O62- / S2O32-
Br2 + 2 e-= 2 Br-
E01 = 1,07 V Couple Oxydant
2 S2O32- =
S4O62- + 2 e- E01
= 0,09 V Couple réducteur
Br2
+ 2 S2O32- = 2 Br- + S4O62-
Log KR = 2 * (1,07 -
0,09 ) / 0,06 = 32,7 - KR=1032,7 - Réaction quasi totale
Exercice 2 :
On titre 20 mL d'une solution d'eau oxygénée
H2O2 de molarité inconnue par une solution 0,025 mol.L-1
de permanganate de potassium (K+ MnO4-). Il
faut verser 12,3 mL de KMnO4 pour atteindre le point équivallent.
Quelle est la molarité de H2O2 ?
H2O2 = O2 +
2 H+ + 2 e- - E01 = 0,69 V - Couple
réducteur
MnO4- + 8 H+
+ 5 e- = Mn2+ + 4 H2O - E02
= 1,51 V - Couple Oxydant
Utilisation des normalités
Le nombre d'électron libéré par H2O2
est égal au nombre d'électron capté par MnO4-
N1V1 = N2V2
(1) MnO4- : 1 mole = 5
moles d'e- è N1 = 5 C1
(2) H2O2 : 1 mole : 2
moles d'e- è N2 = 2 C2
5 C1 V1 = 2 C2 V2
C2 = 5 * 0,025 * 12,3 / (2 * 20) =
0,0384 mol.L-1
Utilisation des molarités
5 H2O2 + 2 MnO4-
+ 16 H+ = 5 O2 + 10 H+ + 2 Mn2+ + 8
H2O
5 H2O2
+ 2 MnO4- + 6 H+ = 5 O2 + 2 Mn2+
+ 8 H2O
5 mole d' H2O2 (2)
réagissent avec 2 moles de MnO4- (1)
5 C1 V1 = 2 C2
V2
Exercice 3 :
Pour déterminer le taux d'alcoolémie d'un
conducteur on procède ainsi : On prélève 5 mL de sang qu'on mélange à 25 mL
d'une solution à 0,005 mol.L-1 de dichromate de potassium (K+
Cr2O72-). Le mélange réactionnel est ensuite
titré par une solution à 0,1 mol.L-1 d'iodure de potassium (K+
I-). Il faut verser 6,6 mL de cette solution de KI pour atteindre le
point équivalent. Quel est le taux d'alcoolémie du conducteur ?
Trois couples interviennent dans ce titrage.
(1) Cr2O72-
+ 14 H+ + 6 e- = 2 Cr3+ + 7 H2O E01
= 1,33 V
(2) CH3CH2OH
+ H2O = CH3COOH + 4 H+ + 4 e- E02
= 0,10 V
(3) I2 + 2 e-= 2 I-
E03 = 1,54 V
On fait d'abord réagir l'oxydant Cr2O72-
sur le réducteur CH3CH2OH.
On fait ensuite réagir le mélange avec le
réducteur I-
Pour que ce titrage puisse fonctionner il
faut mettre Cr2O72- en excès par rapport à CH3CH2OH.
L'excés d'oxydant peut alors être titré par le réducteur I-
Utilisation des normalités :
Le nombre d'e- libérés par les
réducteurs (CH3CH2OH et I-) est égal au nombre
d'électron capté par les oxydants (Cr2O72-).
N2 V2 + N3
V3 = N1 V1
(1) Cr2O72-
1 mole è 6 moles d'e- è N1
= 6 C1
(2) CH3CH2OH
1 mole è 4 moles d'e- è N2 = 4 C2
(3) I-
1 mole è 1 mole d'e- è N3 = C3
4 C2
V2 + C3 V3 = 6 C1 V1
C2 =
( 6 C1 V1 - C3 V3 ) / 4 V2
= (6*0.005*25-0,1*6,6)/20 = 0,045
mol.L-1
M CH3CH2OH
= 12 * 2 + 6 + 16 = 46 g.mol-1
Soit 0,045 * 46 = 0,201 g.L-1
Soit un taux d'alcoolémie de 0,201 g
d'alcool pur par litre de sang.
Exercice 4 :
Calculer le potentiel de Nernst et les
concentrations des diverses espèces pour les mélanges suivants :
1) 20 mL de KI
0,2 mol.L-1 + 50 mL de I2 0,25 mol.L-1
2) 150 mL de
FeCl3 0,12 mol.L-1 + 200 mL de FeCl2 0,22
mol.L-1
3) 200 mL de
KMnO4 0,015 mol.L-1 + 100 mL de FeCl2 0,1
mol.L-1
4) 100 mL de S2O32-
0,025 mol.L-1 + 25 mL de I2 0,125 mol.L-1
1) 20 mL de KI
0,2 mol.L-1 + 50 mL de I2 0,25 mol.L-1
I2
+ 2 e- = 2 I- E0 = 1,54 V
E = E0
+ 0,06 log { [I2] / [I-]2 }
[I2]
= 50 * 0,25 / 70 = 0,179 mol.L-1
[I-]
= 20 * 0,2 / 70 = 0,0571 mol.L-1
E = 0,59 V
2) 150 mL de
FeCl3 0,12 mol.L-1 + 200 mL de FeCl2 0,22
mol.L-1
Fe3+
+ e- = Fe2+ E0 = 0,77 V
E = E0
+ 0,06 log { [Fe3+] / [Fe2+] }
[Fe3+]
= 150 * 0,12 / 350 = 0,0514 mol.L-1
[Fe2+]
= 200 * 0,22 / 350 = 0,1257 mol.L-1
E = 0,75 V
3) 200 mL de
KMnO4 0,015 mol.L-1 + 100 mL de FeCl2 0,1
mol.L-
MnO4- + 8 H+
+ 5 e- = Mn2+ + 4 H2O - E01
= 1,51 V - Couple Oxydant
Fe2+ = Fe3+ + e-
E02 = 0,77 V - Couple réducteur
MnO4-
+ 8 H+ + 5 Fe2+ = Mn2+ + 4 H2O + 5
Fe3+
log K = 5*1*(1,51-0,77)/0,06 = 61,7 - KR
= 1061,7 - Réaction quasi totale
MnO4-
+ 8 H+ + 5 Fe2+ è Mn2+ +
4 H2O + 5 Fe3+
|
|
MnO4- |
H+ |
Fe2+ |
Mn2+ |
Fe3+ |
|
E.I |
0,003 mole(excès) |
(pH=0) Cte (Excés) |
0,01(défaut) |
0 |
0 |
|
E.F |
0,003 - 0,01/5 = 0,001 |
(pH=0) Cte (Excés) |
0 |
0,01/5=0,002 |
0,01 |
[MnO4-]
= 0,001 / 0,3 = 0,00333 mol.L-1
[Mn2+]
= 0,002/0,3= 0,00667
[Fe3+]
= 0,01 / 0, 3 = 0,0333 mol.L-1
[H3O+]
= 1 mol.L-1
K = { [Mn2+]
[Fe3+]5 } / { [MnO4-] [H+]8
[Fe2+]5 }
[Fe2+]5
= 1/ K * { [Mn2+] [Fe3+]5 } / { [MnO4-]
[H+]8 }
[Fe2+]5
= 10-61,7 * { 0,00667 * 0,0333 5 / 0,00333 }
[Fe2+]
= 1,75 10-14 mol.L-1
Le potentiel peut se calculer par un couple
ou l'autre et on doit bien sur obtenir le même résultat.
E =
E02 + 0,06 log { [Fe3+] / [Fe2+] }
= 0,77 + 0,06 log { 0,0333 /1,75 10-14} =1,507 V
E =
E01 + 0,06/5 log {[MnO4-] [H3O+]8/
[Mn2+]} = 1,51 + 0,06/5 log{0,00333 /0,00667} =1,506 V
4) 100 mL de S2O32-
0,025 mol.L-1 + 25 mL de I2 0,125 mol.L-1
n S2O32- =
100 * 0,025/1000 = 0,0025 mole
nI2 = 25*0,125/1000 = 0,003125
mole
2 S2O32- =
S4O62- + 2 e- E01
= 0,09 V Couple réducteur
I2
+ 2 e- = 2 I- E02 = 0,54 V Couple
oxydant
I2
+ 2 S2O32- = S4O62-
+ 2 I-
Log K = 2*(0,54-0,09)/0,06 = 15 - K = 1015
- Réaction quasi totale
2 S2O32-
+ I2è 2 I- +
S4O62-
|
|
S2O32- |
I2 |
S4O62- |
I- |
|
E.I |
0,0025 mole(défaut) |
0,003125(excés) |
0 |
0 |
|
E.F |
0 |
0,003125-0.0025/2= 0,001875 |
0,0025/2=0,00125 |
0,0025*2=0,005 |
[S4O62-]
= 0,00125/0,125 = 0,01 mol.L-1
[I2]
= 0,001875 / 0,125 = 0,015 mol.L-1
[I-]
= 0,005/0,125 = 0,04 mol.L-1
K = [S4O62-]
[I-]2 / { [S2O32-]2
[I2] }
[S2O32-]2
= 1/K [S4O62-] [I-]2 /
[I2] = 10-15 * 0,01 * 0,042 / 0,015 = 1,07 10-18
[S2O32-]
= 1,03 10-9 mol.L-1
Le potentiel peut se calculer par un couple
ou l'autre et on doit bien sur obtenir le même résultat.
E = E01 +
0,03 log { [S4O62-] / [S2O32-]2
} = 0,09+0,03 log { 0,01 /1,07 10-18 } = 0,569 V
E = E02 +
0,03 log { [I2] / [I-]2 } = 0,54 + 0,03
log{0,015 /0,042} =0,569 V
Exercice
5 :
On titre 20 mL d'une solution de Fe3+
à 0,15 mol.L-1 par une solution de Sn2+ à 0,25 mol.L-1.
Tracer la courbe de variation du potentiel de Nernst du mélange réactionnel en
fonction du volume versé de la solution de Sn2+.
(1) Fe3+ + e- = Fe2+
E01 = 0,77 V - Couple oxydant
(2) Sn4+ + 2 e- = Sn2+
E02 = 0,14 V - Couple réducteur
2 Fe3+
+ Sn2+ = 2 Fe2+ + Sn4+
KR
= { [Fe2+]2 [Sn4+] } / { [Fe3+]2
[Sn2+] }
Log KR = 2 * (0,77 - 0,14) / 0,06
= 21
KR = 1021 Réaction
quasi totale
Détermination de Veq :
Nombre d'électrons libéré par Sn2+
= Nombre d'électron capté par Fe3+
(1) Fe3+ : 1 mole capte 1 mole
d'e-
(2) Sn2+ : 1 mole libère 2 mole
d'e-
2 C2 V2 = C1
V1
V2 = C1 V1/ 2 C2
= 0,15 * 20 / ( 2 * 0,25 ) = 6 mL
* Pour V = 0 : Le potentiel n'est pas
calculable théoriquement puisque une seule espèce Fe3+ est présente.
* Pour 0 < V2 < 6 mL : Fe3+
est en excés et Sn2+ est en défaut.
2 Fe3+
+ Sn2+ è 2 Fe2+
+ Sn4+
|
|
Fe3+ |
Sn2+ |
Fe2+ |
Sn4+ |
|
E.I |
C1 V1 |
C2 V2 |
0 |
0 |
|
E.F |
C1 V1 - 2 C2V2 |
0 |
2 C2 V2 |
C2 V2 |
E = E01
+ 0,06 log { [Fe3+] / [Fe2+] }
E = E01
+ 0,06 log { [C1 V1 - 2 C2V2]
/ [2 C2 V2] }
E = 0,77 +
0,06 log { [3 - 0,5 V2] / [0,5 V2] }
Pour V2 > 6 mL : Sn2+
est en excés et Fe3+ est en défaut.
2 Fe3+
+ Sn2+ è 2 Fe2+
+ Sn4+
|
|
Fe3+ (défaut) |
Sn2+ (excés) |
Fe2+ |
Sn4+ |
|
E.I |
C1 V1 |
C2 V2 |
0 |
0 |
|
E.F |
0 |
C2 V2 - C1V1/2 |
C1 V1 |
C1 V1/2 |
E = E02
+ 0,03 log { [Sn4+] / [Sn2+] }
E = E02
+ 0,03 log { [C1 V1 /2] / [ C2 V2 -
C1V1/2] }
E = 0,14 +
0,03 log { [1,5] / [0,25 V2 - 1,5] }
Pour V2 = 6 mL
C'est le point équivallent du titrage.
2 Fe3+
+ Sn2+ = 2 Fe2+ + Sn4+
|
|
Fe3+ (défaut) |
Sn2+ (excés) |
Fe2+ |
Sn4+ |
|
E.I |
C1 V1 |
C2 V2 |
0 |
0 |
|
E.F |
2 e |
e
|
C1 V1 - 2 e |
C2 V2 - e |
(1) E = E01
+ 0,06 log { [Fe3+] / [Fe2+] }
(2) E = E02
+ 0,03 log { [Sn4+] / [Sn2+] }
(2') 2 E = 2 E02
+ 0,06 log { [Sn4+] / [Sn2+] }
1.
+(2') : 3 E = E01 + 2 E02
+ 0,06 log { [Fe3+] [Sn4+] / ([Fe2+] [Sn2+])
}
3 E = E01 + 2 E02
+ 0,06 log R
On a au point
équivallent C1 V1 = 2 C2 V2
[Fe3+] = 2 e / V
[Sn4+] = (C2 V2 - e ) / V
[Fe2+] = (C1 V1 - 2 e) / V = (2 C2 V2 - 2 e) / V = 2 ( C2 V2 - e ) / V
[Sn2+] = e / V
R = [Fe3+] [Sn4+] / ([Fe2+]
[Sn2+]) = 1 è log R = 0
3 E = E01 + 2 E02
E = 1/ 3 (E01 + 2 E02)
= 1/3 (0,77 + 2*0,14) = 0,35 V
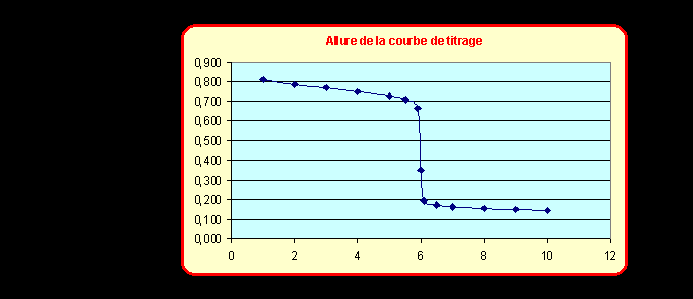
|
V (mL) |
E (V) |
|
1 |
0,812 |
|
2 |
0,788 |
|
3 |
0,770 |
|
4 |
0,752 |
|
5 |
0,728 |
|
5,5 |
0,708 |
|
5,9 |
0,664 |
|
6 |
0,350 |
|
6,1 |
0,193 |
|
6,5 |
0,172 |
|
7 |
0,163 |
|
8 |
0,154 |
|
9 |
0,149 |
|
10 |
0,145 |
Exercice
6 :
On titre 10 mL
d'une solution de Cr2+ à 0,15 mol.L-1 par une solution de
Ce4+ à 0,25 mol.L-1. Tracer la courbe de variation du
potentiel de Nernst du mélange réactionnel en fonction du volume versé de la
solution de Ce4+.
Couple 1 :
Cr3+ + e- = Cr2+ E01 =
-0,41 V - Couple Réducteur
Couple 2 : Ce4+
+ e- = Ce3+ E02 = 1,61 V - Couple
Oxydant
(1) Cr3+
+ e- = Cr2+ E02 = -0,41 V - Couple
réducteur
(2) Ce4+
+ e- = Ce3+ E01 = 1,61 V - Couple
oxydant
Ce4+ +
Cr2+ = Ce3+ + Cr3+
KR = {
[Ce3+]2 [Cr3+] } / { [Ce4+] [Cr2+]
}
Log KR
= (1,61 - -0,41) / 0,06 = 33,67
KR = 1033,67
Réaction quasi totale
Détermination de
Veq :
Nombre
d'électrons libéré par Cr2+ = Nombre d'électron capté par Ce4+
(2) Ce4+
: 1 mole capte 1 mole d'e-
(1) Cr2+
: 1 mole libère 1 mole d'e-
C2 V2
= C1 V1
V2 = C1
V1/ C2 = 0,15 * 10 / 0,25 = 6 mL
Pour V = 0 : Le
potentiel n'est pas calculable théoriquement puisque une seule espèce Cr2+
est présente.
Pour 0 < V2
< 6 mL : Cr2+ est en excés et Ce4+ est en défaut.
Ce4+ +
Cr2+ è Ce3+ + Cr3+
|
|
Ce4+ |
Cr2+ |
Ce3+ |
Cr3+ |
|
E.I |
C2 V2 (défaut) |
C1 V1 (excés) |
0 |
0 |
|
E.F |
0 |
C1 V1 - C2 V2 |
C2V2 |
C2 V2 |
E = E01 + 0,06 log { [Cr3+]
/ [Cr2+] }
E = E01 + 0,06 log { [ C2
V2] / [C1 V1 - C2V2] }
E = -0,41 + 0,06 log { [0,25 V2] /
[1,5 - 0,25 V2] }
Pour V2
> 6 mL : Cr2+ est en défaut et Ce4+ est en excés.
2 Ce4+
+ Cr2+ è 2 Ce2+ + Cr4+
|
|
Ce4+ (excés) |
Cr2+ (défaut) |
Ce3+ |
Cr3+ |
|
E.I |
C2 V2 |
C1 V1 |
0 |
0 |
|
E.F |
C2 V2 - C1V1 |
0 |
C1 V1 |
C1 V1 |
E = E02
+ 0,06 log { [Ce4+] / [Ce3+] }
E = E02 + 0,06 log { [ C2
V2 - C1V1 ] / [C1 V1 ] }
E = 1,61 + 0,06 log { [0,25 V2 -
1,5] / [1,5] }
Pour V2
= 6 mL
C'est le point
équivalent du titrage.
Ce4+ +
Cr2+ = Ce3+ + Cr3+
|
|
Ce4+ |
Cr2+ |
Ce3+ |
Cr3+ |
|
E.I |
C2 V2 |
C1 V1 |
0 |
0 |
|
E.F |
e |
e |
C2 V2 - e |
C1 V1 - e |
(1) E = E01
+ 0,06 log { [Ce4+] / [Ce3+] }
(2) E = E02 + 0,06 log { [Cr3+]
/ [Cr2+] }
(1) + (2) : 2 E = E01
+ E02 + 0,06 log { [Ce4+] [Cr3+] /
([Ce3+] [Cr2+]) }
2 E = E01
+ E02 + 0,06 log R
On a au point équivalent C1 V1
= C2 V2
[Ce4+] = e / V
[Cr3+] = (C2 V2
- e ) / V = (C1 V1 - e) / V
[Ce3+] = (C1 V1
- e) / V
[Cr2+] = e / V
R = [Ce4+] [Cr3+] /
([Ce3+] [Cr2+]) = 1 è log R = 0
2 E
= E01 + E02
E = 1/ 2 (E01
+ E02) = 1/2 (1,61 + -0,41) = 0,60 V
Exercice
7 :
Soient les couples suivants rencontrés
fréquemment en biologie :
(1) Cystine + 2
e- = 2 cystéine E01 = 0,08 V
(2) NAD+
+ 2 e- + H+ = NADH E02 = - 0,11 V
On met en présence toutes les espèces
impliquées dans ces deux couples dans une solution de pH = 0.
Les concentrations des diverses espèces sont
initialement de :
[Cystine] =
[NADH] = 5 10-5 mol.L-1.
[Cystéine] =
[NAD+] = 1 mol.L-1
Calculer les diverses concentration à
l'équilibre.
E1 =
E01 + 0,03 log { [Cystine] / [Cystéine]2 } =
-0,049 V
E2 =
E02 + 0,03 log { [NAD+] [H+] /
[NADH] } = 0,019 V
E2 > E1
L'oxydant le meilleur NAD+ oxyde
le meilleur réducteur Cystéine
NAD+ + 2 e- + H+
= NADH (Couple oxydant)
2 cystéine = Cystine + 2 e-
(Couple réducteur)
NAD+ + H+ + 2 Cystéine
= NADH + Cystine
Log KR = 2 * (-0,11 -
0,08) / 0,06 = -6,33 - KR = 10-6,33
La réaction très peu avancée et quasi
négligeable.
|
|
NAD+ |
H+ |
cystéine |
NADH |
Cystine |
|
EI |
1 |
1 |
1 |
5 10-5 |
5 10-5 |
|
EF |
1 - e |
1 |
1 - 2 e |
5 10-5 + e |
5 10-5 + e |
K = 10-6,33 = [Cystine] [NADH] /
{ [NAD+] [H+] [Cystéine]
Pour simplifier la résolution, on peut
négliger e et 2 e devant 1 puisque e est très petit.
K = 10-6,33 = ( 5 10-5
+ e )2
6,81 10-4 = ( 5 10-5 +
e
)
e =
6,81 10-4 - 5 10-5 = 6,31 10-4
|
Cystine |
6,80 10-4 mol.L-1 |
|
cystéine |
0,99874 mol.L-1 |
|
NAD+ |
0,99937 mol.L-1 |
|
NADH |
6,8010-4 mol.L-1 |
|
H+ |
1 mol.L-1 |
Exercice 8 :
Soient les couples :
CH3-CO-COOH (acide pyruvique) CH3-CHOH-COOH
(acide lactique) - E0'(7)=-0,19 V
CH3CHO (éthanal) CH3CH2OH
(éthanol) - E0'(7) = -0,17 V
- Déterminer les nombres d'oxydation de tous les atomes de carbone
présents dans ces deux composés.
- Equilibrer la réaction spontannée se produisant entre ces deux
couples dans les conditions standards biologiques.
- Déterminer les nombres d'oxydation de tous les atomes de carbone
présents dans ces deux composés.
CH3-CO-COOH : CH3 = -III
- CO = + II - COOH = +III
CH3-CHOH-COOH : CH3 =
-III - CHOH = 0 - COOH = +III
CH3CHO : CH3 = -III - CHO
= + I
CH3CH2OH : CH3
= -III - CH2OH = - I
- Equilibrer la réaction spontannée se produisant entre ces deux
couples dans les conditions standards biologiques.
CH3-CO-COOH
+ 2 H+ + 2 e- = CH3-CHOH-COOH E0'(7)
= - 0,19 V
CH3CHO
+ 2 H+ + 2 e- = CH3CH2OH E0'(7)
= - 0,17 V
Le meilleur oxydant CH3CHO oxyde
le meilleur réducteur CH3CHOHCOOH
CH3CHO
+ CH3-CHOH-COOH = CH3CH2OH + CH3-CO-COOH
Exercice 9 :
Déterminer les nombres d'oxydation des
atomes soulignés dans les composés suivants :
Cr2O72-
- CH3-CH2-CH = CH - CH3 - CH3 -
O - O - H - CH3 - CHOH - SH
Cr2O72- : 2 x - 14 = -2 è x = 6 è Cr (+VI)
CH3-CH2-CH
= CH - CH3 è C(-I)
CH3
- O - O - H è O(-I)
CH3
- CHOH - SH è C(+I) et S(-II)
Exercice 10 :
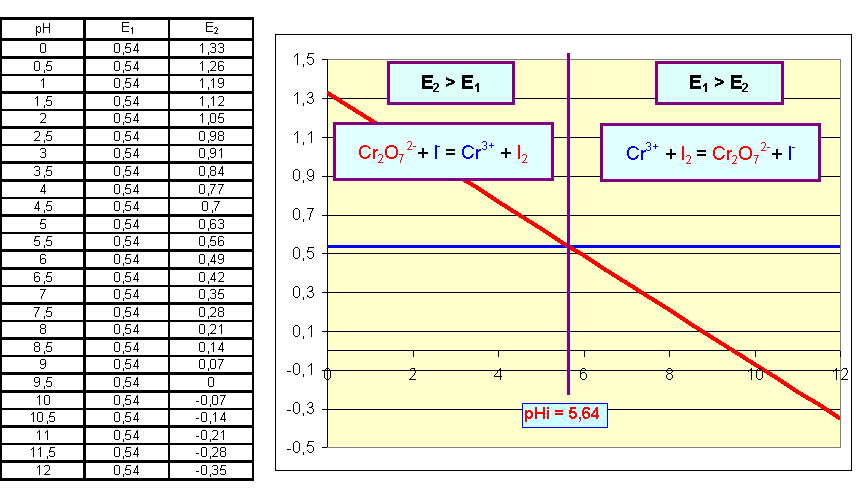
Soient les couples I2/I-
E0=0,54 V et Cr2O72-/Cr3+
E0=1,33 V
Montrer que si toutes les concentrations
(sauf H+) sont fixées à 1 mole.L-1 la réaction spontanée
se produisant entre ces couples dépend du pH.
I2
+ 2 e- = 2 I-
E1 =
E01 + 0,06 log { [I2] / [I-] } =
E01 = 0,54 V - Indépendant du pH
6 e-
+ 14 H+ + Cr2O72- = 2 Cr3+
+ 7 H2O
E2 =
E02 + 0,01 log { [Cr2O72-]
[H+]14 / [Cr3+]2 } = E02
+ 0,01 log [H+]14 = E02 - 0,14 pH
Les deux droites se coupent pour :
0,54 =
1,33 - 0,14 pH
pH = 5,64
pour pH
< 5,64 : E2 > E1 : Cr2O72-
oxyde I-
Cr2O72-+
3 I- + 14 H+ = 2Cr3+ + 3 I2 + 7 H2O
pour pH
> 5,64 : E1 > E2 : I2 oxyde Cr3+
2 Cr3+
+ 3 I2 + 7 H2O = Cr2O72-+
3 I- + 14 H+
Exercice 11 : E0
Cu2+ / Cu = 0,34 V - E0
Zn2+ / Zn = -1,76 V
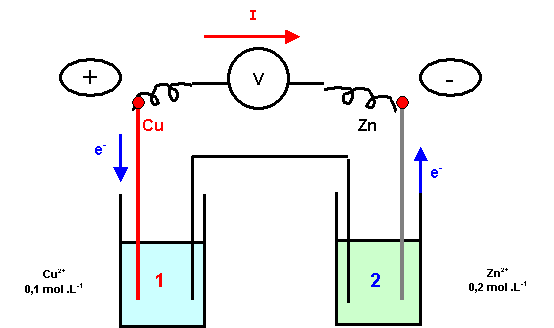
On réalise une pile Cu/Cu2+(0,1
mol.L-1) // Zn2+(0,2 mol.L-1)/Zn.
Schématiser cette pile. Indiquer le
sens du courant quand la pile débite. Ecrire les réactions se produisant à
chaque électrode. Donner sa f.e.m. Calculer les concentrations lorsque la pile
est usée.
Couple
1 : Cu2+ + 2 e- = Cu
E1 = E01 + 0,03 log [Cu2+]
E1 = 0,34 + 0,03 log (0,1) = 0,310 V
Couple 2 : Zn2+ + 2 e- = Zn
E1 = E02 + 0,03 log [Zn2+]
E1 = -1,76 + 0,03 log (0,2) = -1,781 V
E1 > E2
Cu = pôle PLUS
et Zn = pôle MOINS
Electrode 1 =
consommation des e- = réduction = Cathode : Cu2+ + 2
e- = Cu
Electrode 2 =
production des e- = oxydation = anode : Zn = Zn2+ +
2 e-
Fem de la
pile :
DE = E+ - E- = 0.310 - -1,781 = 2,091 V
Réaction
globale : Cu2+ + Zn = Cu + Zn2+
A l’équilibre
= pile usée à DE = 0 à E1
= E2
0,34 + 0,03 log [Cu2+] = -1,76 + 0,03 log [Zn2+]
0,34 + 1,76 = 0,03 log [Zn2+]
- 0,03 log [Cu2+]
2,1 = 0,03 log { [Zn2+] / [Cu2+]
}
2,1 / 0,03 = log { [Zn2+]
/ [Cu2+] } = log K
log K = 70
K = 1070
La réaction
est quasi totale.
Réaction
globale : Cu2+ + Zn = Cu + Zn2+
|
|
Cu2+ |
Zn |
Cu |
Zn2+ |
|
E.I |
0,1 |
Excès |
Excès |
0,2 |
|
E.I |
e |
Excès |
Excès |
0,3 - e |
K =
{ [Zn2+] / [Cu2+] }
K = ( 0,3 – e ) / e
e <<<<
0,3
K = 0,3 / e
e = 0,3 / K
e = 0,3 / 1070
e = 3 10-71 mol.L-1
Soit :
[Cu2+] = 3 10-71 mol.L-1
[Zn2+]
= 0,3 – e = 0,3 mol.L-1