
Rayons de covalence des atomes :
Z*C = 3,25 et n*C = 2 è RC = 0,786 A°
Z*O = 4,55 et n*O = 2 è RO = 0,710 A°
RH = 0,346 A°
Soit pour les longueurs des liaisons :
C - O : 1,46 A°
C = O : 1,25 A°
C - H : 1,05 A°
O - H : 0,97 A°
O - O : 1,37 A°
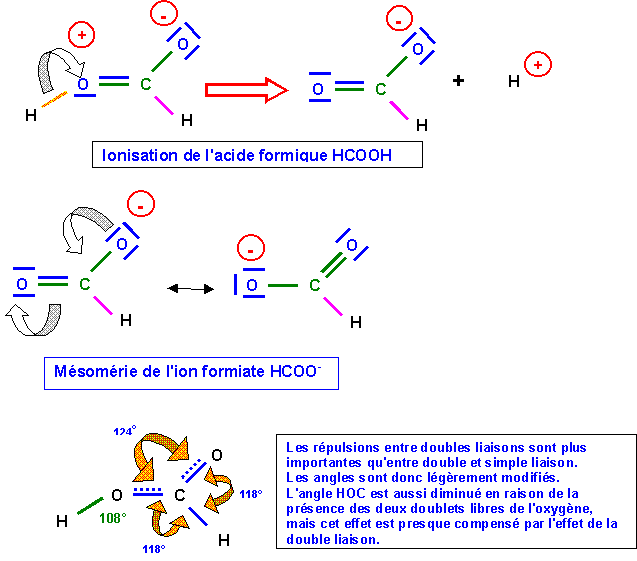
Acide Formique HCOOH
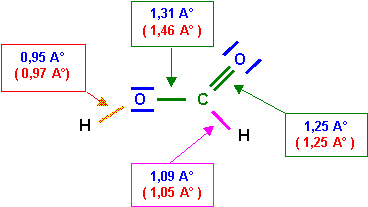
La simple liaison C - O est en réalité plus courte que la valeur approchée calculée grâce à la formule. L'accord est tout à fait satisfaisant pour les autres liaisons.
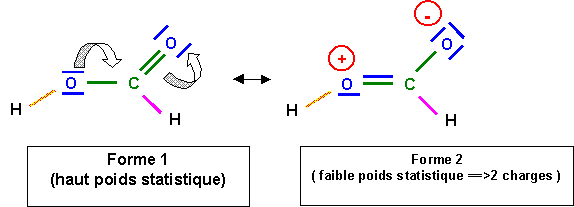
La liaison C - O à un faible caractère de double liaison à cause de la forme 2, cette liaison sera donc intermédiaire entre la simple et la double. Sa longueur de 1,31 A° est bien intermédiaire entre 1,25 et 1,46 A°. La longueur de la double liaison (qui devrait normalement légèrement augmenter) n'est en revanche pas sensiblement modifié, cela est général, les effets de raccourcissement sont toujours nettement plus sensibles que les effets d'allongement.
Dans la forme 2, l'atome d'oxygène lié a H porte une charge formelle positive, l'oxygène étant très électronégatif va chercher à se "débarrasser "de cette charge positive, pour cela il va "voler" les électrons de liaisons avec H. On obtient alors l'ion formiate HCOO- et H+ est libéré ce qui explique l'acidité importante de HCOOH.
7-1)
C : 1s2 ; 2s2 2p2 è Z* = 6 - ( 3 * 0,35 ) - ( 2 * 0,85 ) = 3,25
O : 1s2 ; 2s2 2p4 è Z* = 8 - ( 5 * 0,35 ) - ( 2 * 0,85 ) = 4,55
7-2) Structures de Lewis
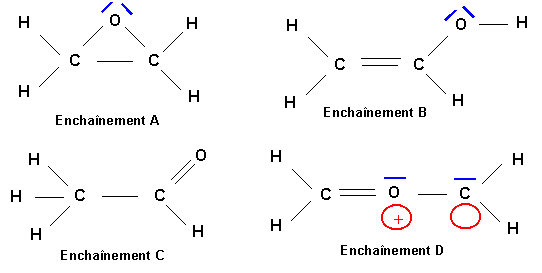
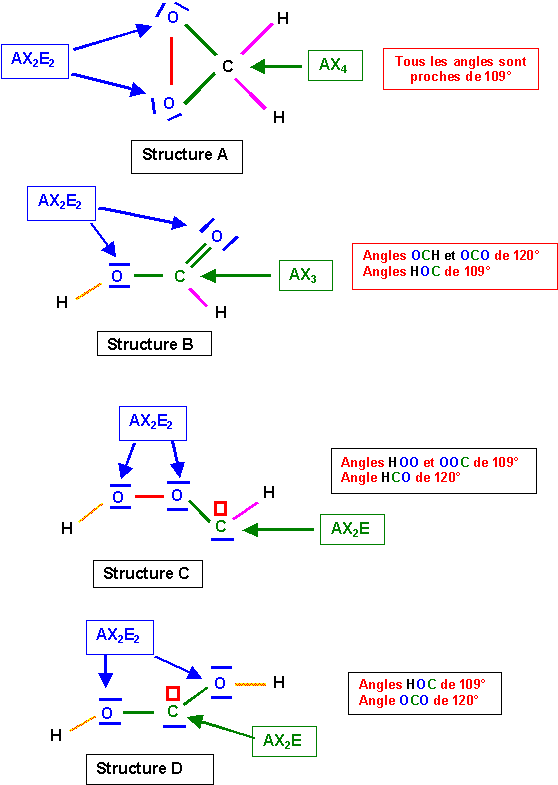
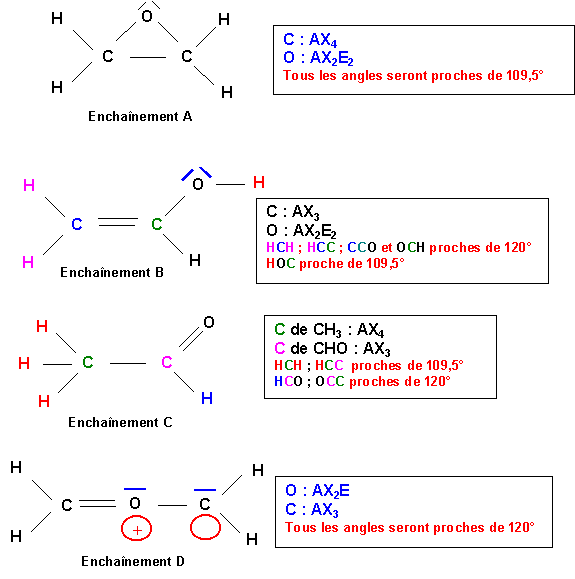
Les enchaînements A, B et C ne posent pas de problèmes particuliers, leurs structure de Lewis est assez facile à deviner. L'enchaînement D est par contre assez "exotique" pour que l'on s'y attarde un peu.
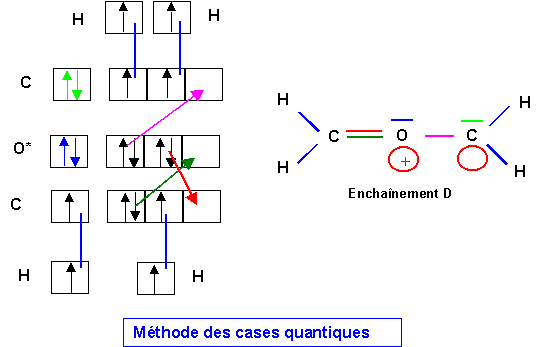
Méthode rapide :
On considère O comme l'atome central et les groupement CH2 comme des atomes latéraux.
O central : 6 électrons
Le groupement CH2 sera considéré comme divalent puisque 2 des électrons de C sont utilisés pour faire des liaisons avec H. Chaque groupement CH2 fera donc une double liaison avec O.
Soit 4 liaisons au total pour le O central. Comme il possède 6 électrons, deux de ses électrons ne sont pas utilisés pour faire des liaisons et il possède donc un doublet libre.
On obtient alors le schéma de Lewis suivant :
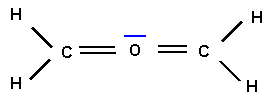
Cette structure ne possède pas de charges formelles.
L'oxygène appartenant à la deuxième période ne peut faire au maximum que 4 liaisons et comme ici il possède un doublet libre (qui compte comme une liaison supplémentaire) cette structure est donc impossible. Pour la corriger il faut supprimer une liaison de O en rabattant un doublet de liaison sur C.
On retrouve bien la forme obtenue par la méthode des cases quantiques.
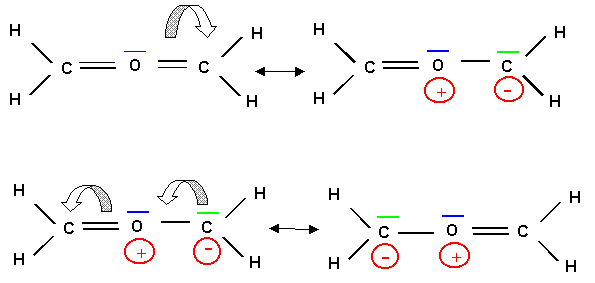
Il existe en réalité deux formes mésomères équivalentes et cette structure est en fait symétrique.
7-3-a)
7-3-b)
Longueur des liaisons :
C - O : 1,46 A°
C = O : 1,25 A°
C - H : 1,05 A°
O - H : 0,97 A°
C - C : 1,54 A°
C = C : 1,325 A°
7-4)
Structure A :
7 liaisons
Liaisons C-H : 1,05
Liaisons C-O : 1,46
Liaisons C-C : 1,54
Impossible : 7 liaisons au lieu de 6
Structure B :
6 liaisons
Liaisons C-H : 1,05
Liaisons C-O : 1,46
Liaisons C=C : 1,325
Liaisons O-H : 0,97
Impossible : 4 types différents au lieu de 3
Structure D :
6 liaisons
Liaisons CH : 1,05
Liaisons CO intermédiaire : 1,25 / 1,46
Impossible : 2 types différents au lieu de 3
Structure C :
6 liaisons
Liaisons C-H : 1,05
Liaisons C=O : 1,25
Liaisons C-C : 1,54
Possible : 6 liaisons de 3 types différents
7-5)
Liaisons C-H : 1,09 A° (1,05)
Liaisons C=O : 1,22 A° (1,25)
Liaisons C-C : 1,5 A° (1,54)
Remarque :
Les structures B et C sont respectivement un énol et un aldéhyde. Il existe une relation particulière appelée "équilibre de tautomérie" entre ces deux formes. La forme aldéhyde est toutefois très largement majoritaire pour ce composé.
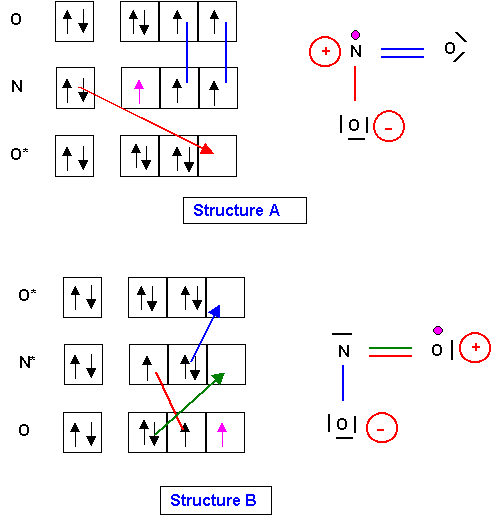
La méthode V.S.E.P.R est basée sur la répulsion des doublets de la couche de valence de l'atome central.
La structure B ne pose aucun problème à ce niveau, sa géométrie est clairement du type AX2E.
Cette structure est plane en forme de V avec un angle ONO légèrement inférieur à 120° à cause du doublet libre.
En revanche, dans la structure A, l'atome central possède un électron célibataire. Cette situation n'est pas prévue par la méthode V.S.E.P.R qui ne considère que des doublets d'électrons. On ne peut associer clairement un type moléculaire classique a cette structure. Pour se fixer les idées nous dirons qu'elle est du type AX2e, le e minuscule désignant l'électron célibataire. Ce type moléculaire n'étant pas prévu par la V.S.E.P.R il est difficile d'y associer une géométrie précise.
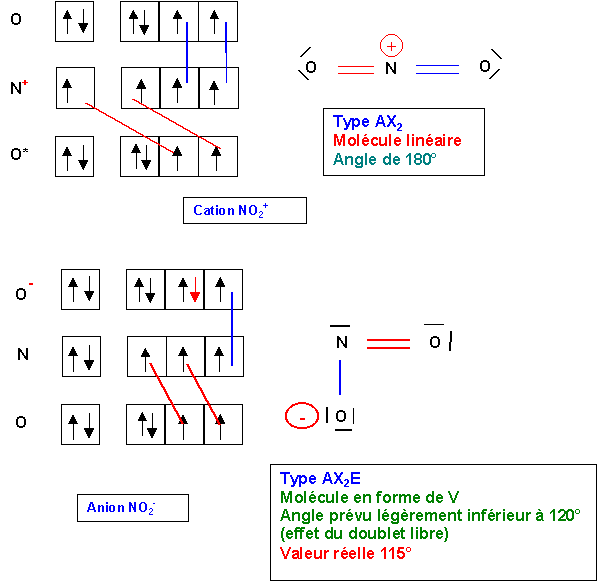
La molécule NO2 est intermédiaire entre NO2+ et NO2- puisque ces ions sont obtenus en ajoutant ou en enlevant un électron à NO2. Géométriquement cela se traduit par un angle ONO de 134 ° intermédiaire entre 180° (NO2+) et 115°(NO2-).
L'angle étant supérieur à 120°, la structure B est exclue puisque dans ce cas cet angle serait inférieur à 120° à cause de la présence du doublet libre.
C'est donc la structure A qui représente ce radical NO2.
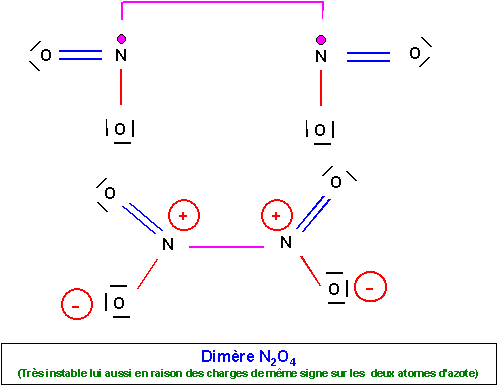
Ce radical se dimèrisera facilement par formation d'une liaison entre les deux atomes d'azote.