
Electronégativité de Pauling - Liaisons polarisées - Moments dipolaires
L'électronégativité dans l'échelle de Pauling se calcule à partir des énergies de liaisons selon la formule :

Les énergies de liaisons devant être exprimées en eV/atome. Le premier travail consiste donc à convertir les énergies de liaisons. Le facteur de conversion pour passer des Kj mol-1 aux eV est 1000/Ne = 1000/F = 1000/96500 = 0,01036.
| H -H | F - F | Cl - Cl | H - F | H - Cl | |
| E KJ mol-1 | 435 | 155 | 242 | 566 | 431 |
| E ev | 4,508 | 1,606 | 2,508 | 5,865 | 4,466 |
Détermination de XF
AA = H2 ; BB = F2 ; AB = HF
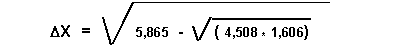
DX = 1,78
Le DX calculé représente l'écart entre les électronégativités de A et de B, mais nous ne savons pas à priori quel est l'élément le plus électronégatif.
On a donc à priori deux solutions :
En fait ici le problème ne se pose pas vraiment puisque nous savons que F est l'élément le plus électronégatif de la classification périodique. On a donc XF > XH et XF = XH + DX
XF = 2,2 + 1,78 = 3,98
Détermination de XCl
AA = H2 ; BB = Cl2 ; AB = HCl
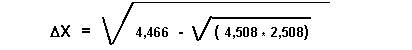
DX = 1,05
2 solutions possibles à priori :
Pour choisir entre les deux hypothèses un renseignement supplémentaire est nécessaire.
Il est bien connu que HCl est un acide fort totalement dissocié dans l'eau en H+ et Cl-, cela implique que la liaison H - Cl est polarisée H+d - Cl-d et donc que Cl est plus électronégatif que H.
Donc XCl = 3,25 est la bonne solution.
d = m / d
Si d = e la liaison est purement ionique, le pourcentage d'ionicité s'exprime donc par le rapport d/e.
%IAB = 100 * d / e = (100 * m ) / ( d * e )
Attention aux unités dans le système international m s'exprime en C.m, d en m et e = 1,6 10-19 C.
Avec les unités couramment utilisées en chimie m est exprimé en Debye et d en Amstrong.
La formule devient : %IAB = 20,8 * m(D)/d(Å)
| m (D) | d (A°) | %IAB | |
| H - Cl | 1,08 | 1,27 | 17,7 |
| H - Br | 0,79 | 1,42 | 11,6 |
| H - I | 0,38 | 1,61 | 4,9 |
On remarque que le pourcentage d'ionicité est directement relié à l'écart des électronégativités plus l'écart d'électronégativité est important et plus le pourcentage d'ionicité est élevé.
Cela est à la base de la formule empirique de Hanney-Smith %IAB = 16 DX + 3,5 DX2
ou de la formule plus complexe de Pauling %IAB = 100 ( 1 - exp(- (DX)2/4))
A titre de vérification de la validité de ces formules de calcul approchée, on peut vérifier pour HCl puisque nous avons déterminé XH et XCl dans l'exercice précédent : DX = 1,05.
Hanney-Smith : %IHCl = ( 16 * 1,05 ) + ( 3,5 * 1,052 ) = 20,6 %
Pauling : %IAB = 100 ( 1 - exp(- (1,05)2/4)) = 24 %
L'ordre de grandeur est donc correctement évalué par les deux formules.
La formule de Hanney-Smith donne généralement de bons résultats et est intéressante de part sa grande simplicité.
La géométrie de la molécule est bien du type AX2E en forme de V avec un angle proche de 120°.
La valeur expérimentale de l'angle 119° est justifiée par la présence du doublet libre qui est pratiquement compensée par celles des deux doubles liaisons, l'effet du doublet libre l'emporte tout de même et l'angle est très légèrement inférieur à 120°.
Si on examine les deux formes mésomères on accordera un poids statistique plus important à la forme à deux doubles liaisons et non chargée puisqu'elle possède à la fois d'avantage de liaisons et moins de charges que l'autre forme.
Remarque : la règle de l'octet n'est pas respectée pour cette forme alors qu'elle l'est pour l'autre, mais cette règle ne s'applique strictement qu'aux éléments de la deuxième période ce qui n'est pas le cas du soufre.
On peut aussi s'intéresser à la longueur expérimentale des liaisons.
Z*S = 5,45 , n*S = 3 , Z*O = 4,55, n*O = 2 soit pour les longueurs des liaisons S - O :
Simple 1,72 A° - Double : 1,48 A° - Triple 1,34 A°
La longueur réelle de la liaison de 1,43 A° est légèrement plus courte que la valeur approchée calculée pour la liaison double SO. Cela est en accord avec l'hypothèse que la forme mésomère à doubles liaisons est bien la forme la plus représentative de la molécule réelle. Nous verrons que le raccourcissement observé peut être attribué à la forte polarité de la liaison SO.
Calcul des charges partielles et du pourcentage d'ionicité :
Les moments dipolaires des liaisons s'ajoutent vectoriellement, leur résultante est le moment dipolaire global de la molécule. Ici le moment dipolaire global est connu et nous cherchons le moment dipolaire partiel d'une liaison SO qui nous permettra ensuite de déterminer le pourcentage d'ionicité de la liaison.
Nous négligerons le moment dipolaire partiel du au doublet libre qu'il est impossible d'évaluer.
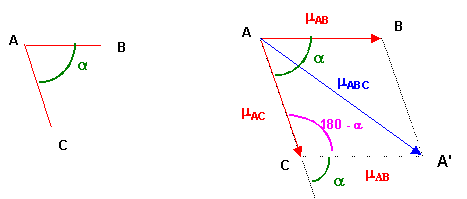
Théorème de Pythagore généralisé : Triangle ACA'
mABC2 = mAB2 + mAC2 - 2 mAB mAC cos (180 - a)
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
Ici on à de plus mAB = mAC = mSO
mSO22 = mSO2 + mSO2 + 2 mSO mSO cos a
mSO22 = 2 mSO2 + 2 mSO2 cos a
mSO22 = 2 mSO2 ( 1 + cos a )
Soit mSO2 = mSO22 / 2 ( 1 + cos a )
Application numérique :
mSO2 = 1,652 / 2 ( 1 + cos 119 ) = 2,64
mSO = 1,625 D
%ISO = 20,8 * 1,625 / 1,43 = 23,6 %
Soit d = 0,24 e = 3,68 10-20 C
Cette liaison 24 % ionique est plus polarisée que la liaison H-Cl pour laquelle le pourcentage d'ionicité n'est que de 17 %, cette forte ionicité justifie le raccourcissement de la liaison observé.
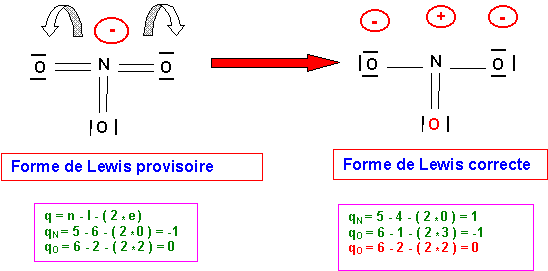
Détermination de la structure de Lewis : (Méthode "rapide")
N est l'atome central, il possède 5 électrons sur sa couche de valence. Si on lui attribue l'électron supplémentaire correspondant à la charge de l'ion, il possédera donc 6 électrons.
L'oxygène atome latéral est supposé former des doubles liaisons par ses deux électrons célibataires. N fera donc au total 6 liaisons avec les trois atomes d'oxygène. Les 6 électrons de N étant tous utilisés pour faire des liaisons il ne possède donc pas de doublets libres. Il possède en revanche un électron excédentaire et porte donc une charge formelle négative. La forme obtenue présente 6 liaisons pour N qui est un élément de la deuxième période et ne peut donc faire que 4 liaisons au maximum (une liaison par case quantique). Il faut donc supprimer 2 liaisons en rabattant les doublets correspondants sur les atomes d'oxygène.
Il existe en fait trois formes mésomères équivalentes en échangeant le rôle des oxygènes.
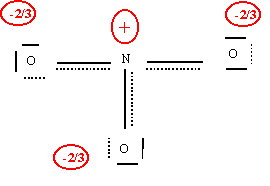
Les liaisons sont toutes identiques et les oxygènes indicernables.
Le type moléculaire est AX3, la molécule sera plane triangulaire avec des angles de 120° exactement puisque parfaitement symétrique à cause des trois formes mésomères équivalentes.
Puisque O est plus électronégatif que N, la liaison sera polarisée N+d - O-d
Le moment dipolaire de liaison sera dirigé de N vers O.
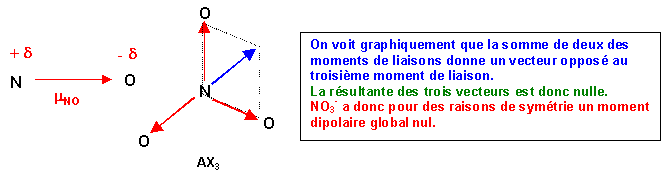
On pourrai retrouver ce résultat par le calcul (voir exercices précédants):
Ici a = 120° et cos a = - 0,5
m1,22 = m12 + m22 + 2 m1 m2 cos a
Avec de plus m1 = m2 = m
m1,22 = m2 + m2 + 2 m2 cos a = 2m2 ( 1 + cos a ) = 2m2 ( 1 - 0,5 ) = m2
La somme de deux des moments dipolaire de liaison est bien équivalente au troisième.
Cette molécule à été étudiée à l'exercice 8 de la première série d'exercices. Le calcul du moment dipolaire global se fait sans difficulté particulière comme lors de l'étude de SO2 (voir exercice 3) avec ici a = 134°
mNO22 = 2 mNO2 ( 1 + cos a ) = 2 * 0,152 * ( 1 + cos 134 ) = 0,0137
mNO2 = 0,117 D
La structure de Lewis de CO2 est bien connue, celle de CS2 et COS s'en déduisent puisque S et O appartiennent à la même colonne de la classification et ont donc la même configuration électronique et des propriétés chimiques semblables. Les trois molécules sont linéaires (type AX2). CO2 et CS2 étant parfaitement symétriques leur moment dipolaire global est nécessairement nul puisque les deux moments de liaison opposés s'annulent mutuellement et ce quelque soient les électronégativités des atomes concernés. La molécule CS2 n'est pas symétrique et elle possédera donc un moment dipolaire. Le sens de celui-ci dépendra des électronégativités comparées de C, O et S. On sait sans calcul que O est à la fois plus électronégatif que C (à droite de lui sur la même ligne) et plus électronégatif que S (plus haut dans la même colonne).Il n'est en revanche pas évident de savoir quel est le plus électronégatif entre C et S seule la consultation d'une table permet de le savoir à coup sur.
On peut tout de même prévoir puisque O est plus électronégatif que S, il attirera plus fortement les électrons que celui-ci et que le moment dipolaire de la liaison C-O sera plus important que celui de la liaison C-S dans la molécule mixte CS2. Que le moment de C-S s'ajoute ou se retranche de celui de C-O, n'a donc pas d'importance puisque celui de C-O est le plus important c'est lui qui fixera le sens du moment dipolaire global qui sera forcément dirigé dans le sens Cà O.
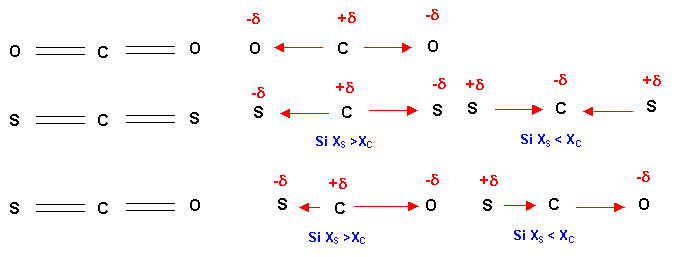
En fait il se trouve que C et S ont pratiquement la même électronégativité de 2,6 dans l'échelle de Pauling. La liaison C-S est donc très peu polarisée et son moment dipolaire est pratiquement nul.