INTERACTIONS DE FAIBLES ENERGIES - LIAISONS HYDROGENE
Le butane ne présente que des liaisons C-C et C-H. Les liaisons C-C sont évidemment non polarisées. Les liaisons C-H le sont très peu car C et H ont des électronégativités très proches.
XC = 2,6 et XH = 2,2 dans l'échelle de Pauling.
Le butane ne présente donc aucune liaisons fortement polarisées et présentera donc peu d'interaction de type Keesom entre moment dipolaires permanents.
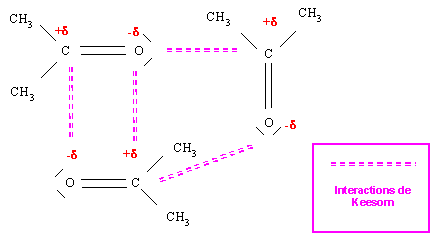
En revanche l'acétone présente des liaisons C-O fortement polarisées (XO = 3,4) et les interaction de Keesom seront donc importantes pour ce composé.

Les points d'ébullition et de fusion de l'acétone seront anormalement élevés, car il faudra vaincre ces forces de Keesom pour produire le changement d'état. L'attribution des températures de changement d'état est donc le suivant :
T1 = -138°C et T3 = -95°C qui sont les deux températures les plus basses sont les deux points de fusion et l'acétone correspond au plus élevé, soit T2.
T2 = -0,5°C et T4 = +56°C qui sont les deux températures les plus élevées sont les deux points d'ébullition et l'acétone correspond au plus élevé, soit T4.
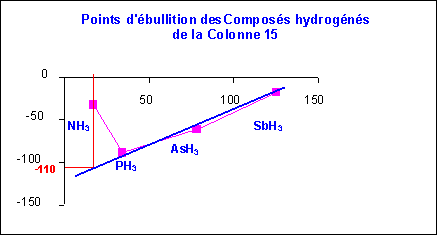
Une représentation graphique montre clairement que NH3 présente des températures de changement d'état anormalement élevées par rapport aux autres composés hydrogénés des éléments de la même colonne.
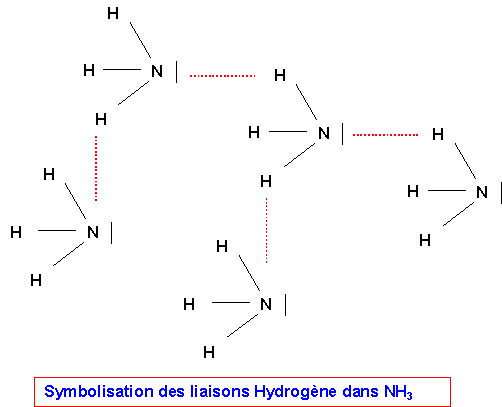
On explique cela par l'existence de fortes interactions de Keesom dues au liaisons N-H fortement polarisées (XN = 3,0 et XH = 2,2).
Ces interactions particulièrement importantes sont nommées liaisons Hydrogène.
On peut estimer graphiquement que NH3 devrait avoir un point d'ébullition d'environ - 110°C si ces interactions n'existaient pas.