Quelques notions quantiques - Ondes de De Broglie - Principe d'Heisenberg
Formule de De Broglie : l = h / p = h / m v
l = 6,62 10-34 / (15 10-3 * 270) = 1,6 10-34 m : Onde indécelable
v = h / l m = 6,62 10-34 / (10-14 * 15 10-3) = 4,4 10-8 m s-1 ( soit 1,6 10-14 km / h)
Cette vitesse est extrêmement faible et n'a pratiquement aucun sens physique. Pour mieux s'en rendre compte elle correspond à un déplacement d'a peine 1,5 Km en mille ans. C'est l'immobilité quasi parfaite.
A l'échelle du monde macroscopique les ondes de De Broglie sont absolument indiscernables et sans influence, on peut les négliger totalement.
l = 6,62 10-34 / (9,1 10-31 * 5 107) = 1,45 10-11 m : Onde décelable
l = 6,62 10-34 / (9,1 10-31 * 270) = 2,7 10-6 m : Onde décelable
A l'échelle du monde microscopique les ondes de De Broglie ont une existence réelle et se manifestent physiquement (diffraction des électrons par exemple).
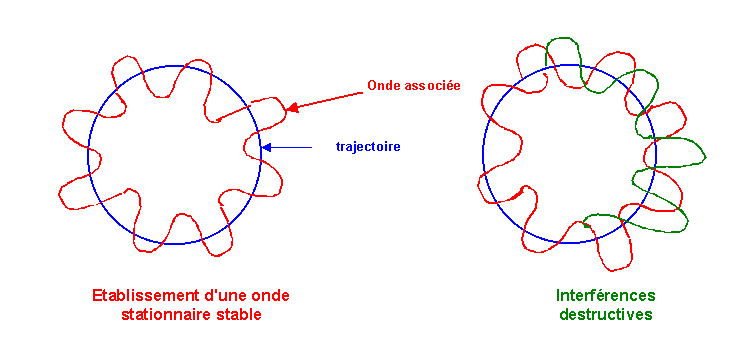
L'électron en tournant sur son orbite circulaire est "accompagné" de son onde de De Broglie qui tourne avec lui. Pour que l'onde puisse être stationnaire il faut qu'elle n'interfère pas avec elle-même (soit en phase avec elle-même). Cette condition n'est remplie que si la longueur de la trajectoire contient exactement un nombre entier de fois la longueur d'onde.
Soit 2 p R = n l = n (h / p) = n (h / m v )
soit finalement : m v R = n ( h / 2 p)
On retrouve la condition de quantification du moment cinétique postulée par Bohr, mais elle trouve ici une explication rationnelle.

Dp Dx > h / (2 p )
p = m v è Dp = m Dv
Dx Dv > h / ( 2 p m )
Dv > h / ( 2 p m Dx)
Dv > 2 108 m s-1
L'incertitude sur la vitesse est énorme puisqu'elle est d'environ 10% de la vitesse de la lumière qui est la vitesse la plus grande qui puisse exister d'après la théorie de la relativité d'Einstein.
b) DV > 10-25 m s-1
Cette incertitude est extrêmement faible et correspond en fait à une précision extraordinaire.
Comme les ondes de De Broglie, le principe d'Heisenberg ne se manifeste pas à notre échelle macroscopique. Inutile de l'invoquer en cas de contrôle de vitesse, les forces de l'ordre connaissent avec précision et votre vitesse et votre position. En revanche ce principe d'incertitude est incontournable à l'échelle des atomes ou des molécules.
Recouvrement des orbitales atomiques - Hybridation des Orbitales Atomiques
C : 1s2 2s2 2p2
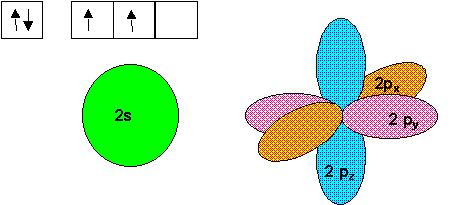
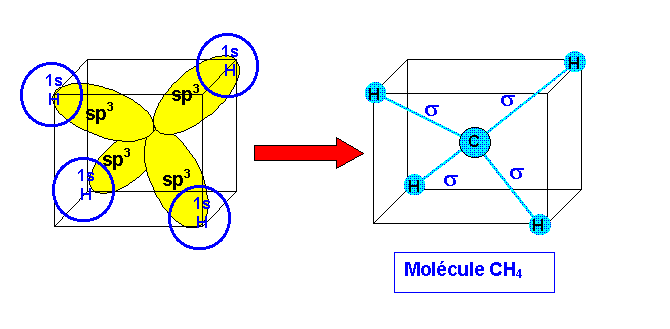
Si on utilise les états fondamentaux de C et H on obtient CH2
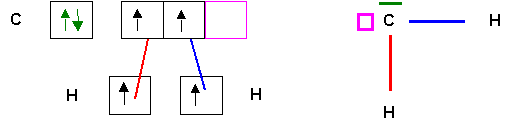
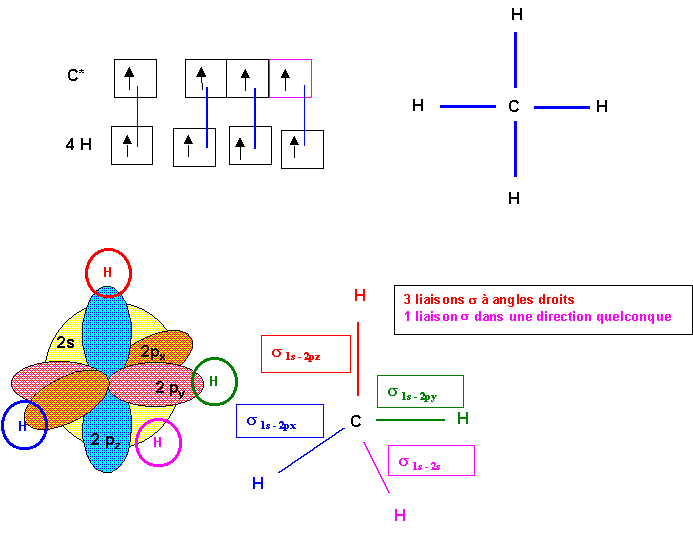
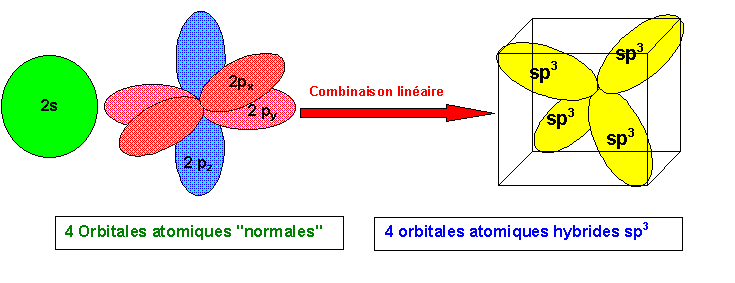
En fait on peut obtenir CH4 par excitation de C.
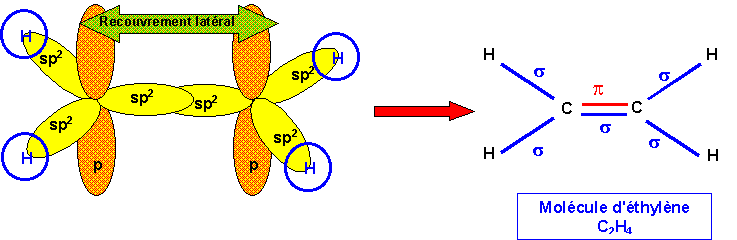
Ethylène : CH2=CH2
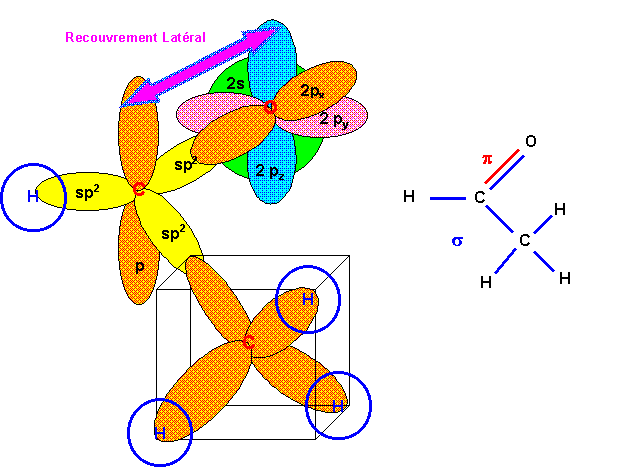
La géométrie autour des atomes de Carbone est du type AX2, l'hybridation du Carbone est donc sp2.
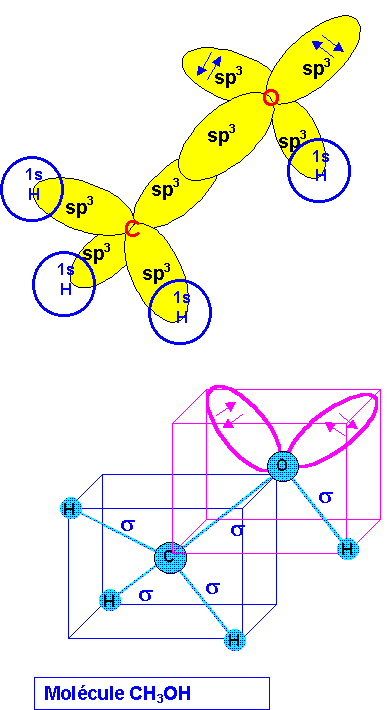
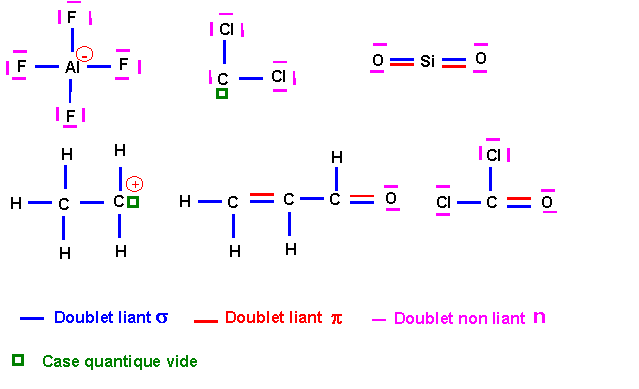
Méthanol CH3OH
La géométrie autour de l'atome de Carbone est du type AX4 (hybridation sp3), celle de l'atome d'Oxygène est du type AX2E2 (hybridation sp3).
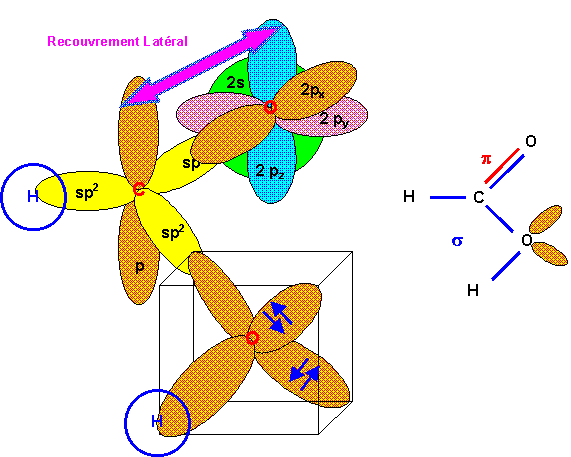
Acide Méthanoïque HCOOH
Le carbone est hybridé sp2 (type AX2), l'oxygène lié à H est supposé en hybridation sp3 (type AX3) et l'oxygène lié seulement à C est supposé non hybridé.
Ethanal CH3CHO
Allène CH2=C=CH2
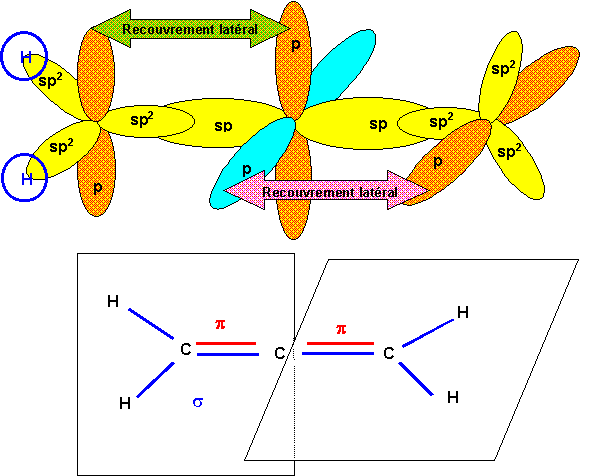
L'atome de carbone central est hybridé sp (type AX2) les deux carbones latéraux sont hybridés sp2 (type AX3). Les deux "triangles équilatéraux" correspondant aux carbones sp2 sont nécessairement dans deux plans perpendiculaires pour que les deux liaisons p puissent se faire simultanément.
Orbitales Moléculaires - Modèle C.L.O.A - O.M
Molécule Li2 :
Li 2s1
Interaction 2s - 2s : obligatoirement axiale è Liaison s
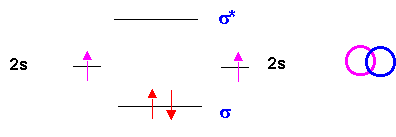
L'indice de liaison est nl = 1/2 ( 2 - 0 ) = 1 pour Li2
Si on enlève un électron à Li2 pour former Li2+ on déstabilise la molécule puisqu'on enlève un électron liant. L'énergie de la liaison est abaissée, elle sera plus facile à dissocier. L'indice de liaison diminue de 0,5 et la longueur de la liaison augmente.
Molécule C2
C : 2s2 2p2
Il y a ici interactions 2s-2s, 2p-2p et 2s-2p. Le diagramme de corrélations des O.M est le suivant :
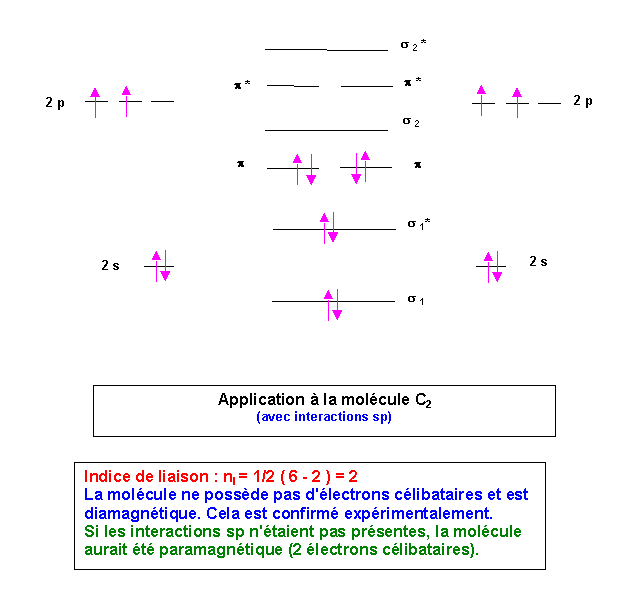
Si on enlève un électron pour former C2+, la molécule sera déstabilisé puisqu'il s'agit d'un électron liant. L'indice de liaison diminuera, la longueur de liaison augmentera et l'énergie de liaison diminuera.
F : 2s2 2p5
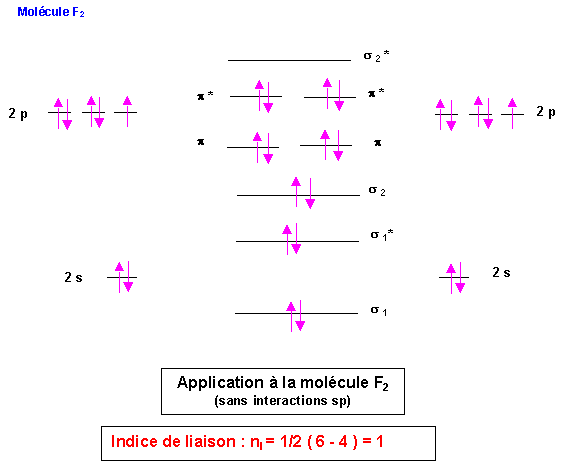
Ici encore enlever un électron déstabilise la molécule.
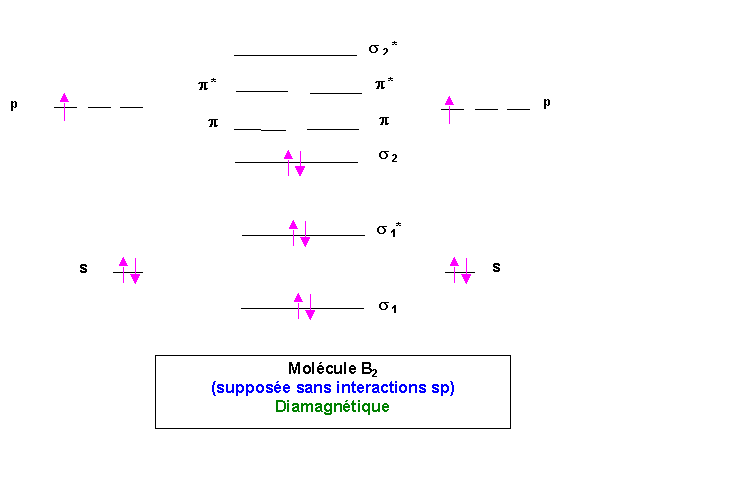
Molécule O2
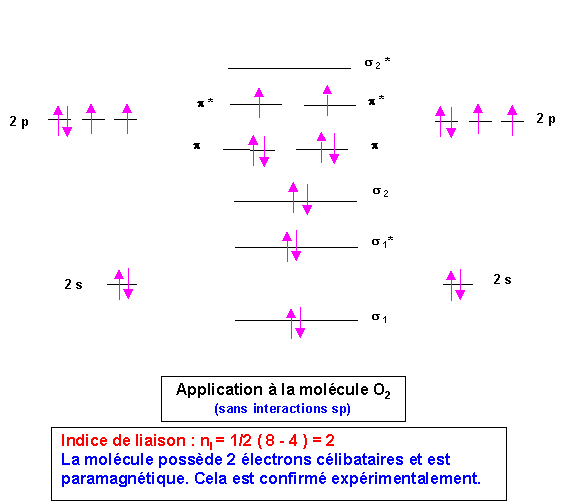
Le dernier niveau occupé est anti-liant, enlever un électron stabilisera la molécule. Inversement l'ajout d'un électron déstabilisera la molécule.
O2+ est plus stable que O2 qui est lui même plus stable que O2-.
énergies de dissociation : E O2+ > E O2 > E O2-
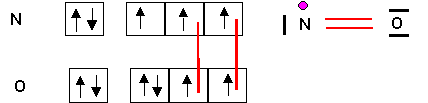
Il y a bien un électron célibataire et NO est donc paramagnétique.
O étant le plus électronégatif , ses niveaux d'énergies seront les plus bas.
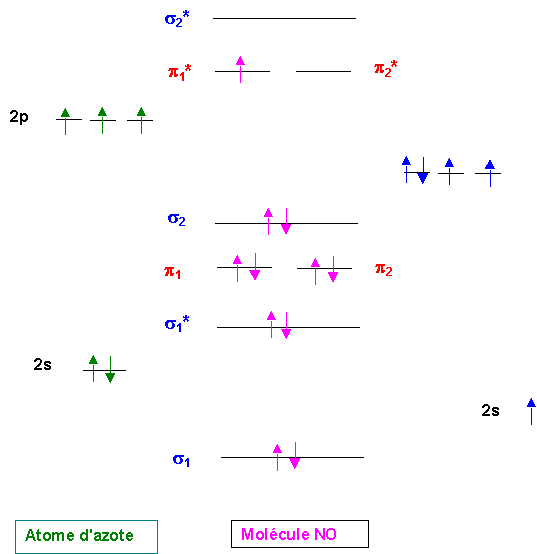
Il y a bien un électron célibataire et NO est paramagnétique.
Z*N = 3,9 - n*N = 2 è RN = 0,742 A°
Z*O = 4,55 - n*O = 2 è RO = 0,71 A°
LNO Simple : 1,41 A° - LNO Double : 1,21 A° - LNO Triple : 1,10 A°
La longueur expérimentale de 1,15 A°est intermédiaire entre la double et la triple liaison
Le calcul de l'indice de liaison donne : nl = 1/2 ( 8 - 3 ) = 2,5
L'ionisation de NO en NO+ correspond à l'enlévement d'un électron antiliant et stabilise donc la molécule. L'ion NO+ est donc facile à obtenir. On remarque que NO+ est isoélectronique de N2 (10 électrons) sont indice de liaison est 3, la liaison N-O sera donc plus courte dans NO+ que dans NO.
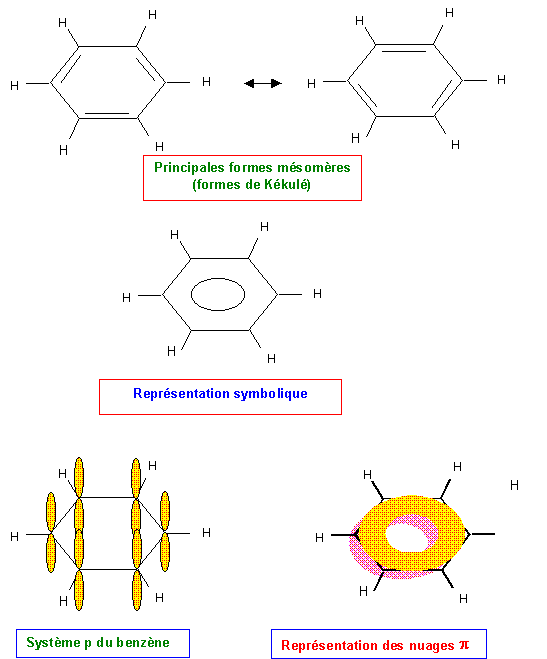
Benzène C6H6 :
Nitrobenzène : C6H5-NO2
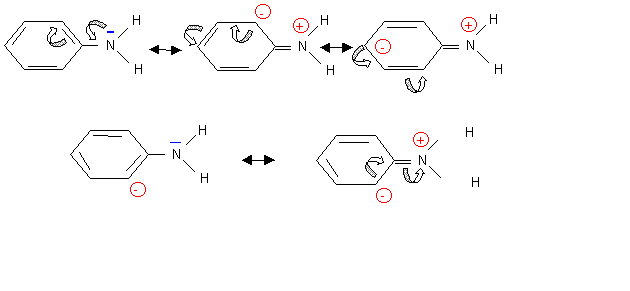
Aniline : C6H5-NH2