![]()
![]()
THERMODYNAMIQUE
Exercice 1
:On donne, les chaleurs de combustion correspondant aux enthalpies molaires de référence des réactions suivantes :
![]()
![]()
![]()
![]()
Calculer l'enthalpie molaire de référence de la réaction d'hydrogénation du benzène en cyclohexane
![]()
Exercice 2
:Déterminer l'enthalpie molaire de référence de combustion de l'acétylène, ainsi décrite :
![]()
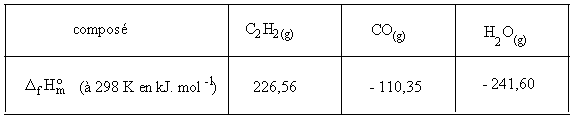
Exercice 3 :
Calculer l'enthalpie de la réaction suivante à 298 K,
DrH°.C2H6 (g) + 7/2 O2 (g) = 2 CO2 (g) + 3 H2O (g)
On donne :
|
liaison |
C-C |
C-H |
O=O |
C=O |
O-H |
|
énergie de liaison en kJ.mol-1 à 298 K |
347,36 |
410,48 |
493,24 |
798,38 |
462,31 |
2°) Calculer
DrH°398On donne :
C°p,m(C2H6,g) = 53,1 J mol.-1 K-1
C°p,m(O2,g) = 29,47 J mol.-1 K-1
C°p,m(CO2,g) = 37,24 J mol.-1 K-1
C°p,m(H2O,g) = 32,14 J mol.-1 K-1
On supposera C°p,m constant dans l'intervalle de température considérée.
Exercice 4
:2 SO2 (g) + O2 (g) = 2 SO3 (g)
Calculer la constante KR de l'équilibre à la température de 25°C.
|
|
SO2(g) |
O2 (g) |
SO3 (g) |
D f G°298 (kJ.mol.-1) |
-300,37 |
0 |
-370,37 |
Exercice 5 :
Soit la réaction :
A(g) + 2 B(g) = C(s)
On donne pour cette réaction les valeurs de KR pour 4 températures :
|
T (K) |
KR |
|
300 |
35608 |
|
500 |
996 |
|
1000 |
68 |
|
2000 |
18 |
1) Déterminer
DRG03002) Déterminer DRH0 et DRS0 en supposant qu'elles sont indépendantes de la température.
Exercice 6
On étudie la réaction suivante : A(g) + B(s) = 2 C(g)
Pour diverses températures on a déterminé la constante K de cet équilibre. On a trouvé les valeurs suivantes :
|
T (° C) |
K |
|
27 |
0,018 |
|
127 |
0,222 |
|
327 |
2,725 |
1) Prévoir sans calculs et en justifiant simplement votre réponse :
a.le signe de
DRH0b.le signe de DRS0
2) Déterminer les valeurs de DRH0 et DRS0
On donne R = 8,314 J mol-1 K-1
3) On appelle température d'inversion d'un équilibre la température pour laquelle sa constante est égale à l'unité. Déterminer la température d'inversion de cet équilibre.
4) Prévoir qualitativement l'influence d'une augmentation de pression sur cet équilibre.
5) Prévoir qualitativement l'influence à pression constante :
Exercice 7
:On donne E0 Fe3+/Fe2+ = 0,77 V et E0 Fe2+/Fe = -0,44 V. Calculer E0 Fe3+/Fe
Exercice 8
:C=12 H=1 O=16
On étudie l’équilibre d’estérification entre l’acide éthanoïque (CH3COOH) et le méthanol (CH3OH) qui fournit de l’éthanoate de méthyle (CH3COOCH3) et de l’eau.
- Ecrire l’équilibre correspondant.
- Lors d’une expérience, on mélange 6 g d’acide éthanoïque pur et 3,2 g de méthanol pur. On laisse la réaction se faire jusqu’a ce que l’équilibre soit établi. On analyse alors le mélange réactionnel et on trouve qu’il s’est formé 0,07 mole d’eau. Calculer la constante de cet équilibre.
- Lors d’une autre expérience on fait réagir 10 g d’acide éthanoïque pur et 20g de méthanol pur. Quelle sera la composition du mélange à l’équilibre ?
- Lors d’une troisième expérience on mélange 1 mole d’éthanoate de méthyle et 36 g d’eau. Quelle sera la composition du mélange à l’équilibre ?
Exercice 9
:A partir des constantes d’équilibre connues calculer les constantes d’équilibre inconnues.
(1) A + B = 2C (K1 = 10)
(2) B + 2D = E (K2 = 0,5)
(3) E + 2A = 2F (K3 = 1,5)
(4) 2B = E (K4 = 25)
(5) A + 2D = 2C (K5 = ?)
(6) 2D + A = F (K6 = ?)
(7) A + B = F (K7 = ?)