THERMODYNAMIQUE
Exercice 1
:On donne, les chaleurs de combustion correspondant aux enthalpies molaires de référence des réactions suivantes :
![]()
![]()
![]()
![]()
Calculer l'enthalpie molaire de référence de la réaction d'hydrogénation du benzène en cyclohexane
![]()
(5) = (1) + 3*(2) - (3) + 3*(4)
C6H6(l) + 15/2 O2(g) + 3 H2(g) + 3/2 O2(g) + 6 CO2(g) + 6 H2O(l) +3 H2O(g)
= 6 CO2(g) + 3 H2O(l) + 3 H2O(g) + C6H12(l) + 9 O2(g) + 3H2O(l)
D
RH05 = DRH01 + 3 DRH02 - DRH03 + 3 DRH04D
RH05 = -3272,94 + 3*-242,02 + 3925,02 + 3*-43,47 = -204,39 KJ.mol-1
Exercice 2 :
Déterminer l'enthalpie molaire de référence de combustion de l'acétylène, ainsi décrite :
![]()
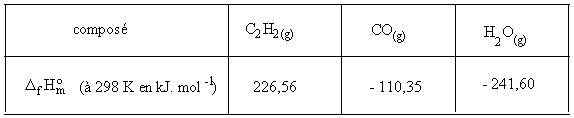
D
RH0 = S ni DRHf0iD
RH0 = 2*-110,35 + -241,60 - 226,56 - 3/2 * 0 = -668,86 KJ.mol-1
Exercice 3 :
Calculer l'enthalpie de la réaction suivante à 298 K, DrH°.
C2H6 (g) + 7/2 O2 (g) = 2 CO2 (g) + 3 H2O (g)
On donne :
|
liaison |
C-C |
C-H |
O=O |
C=O |
O-H |
|
énergie de liaison en kJ.mol-1 à 298 K |
347,36 |
410,48 |
493,24 |
798,38 |
462,31 |
D
RH0 = S E liaison détruites - S E liaisons forméesD
RH0 = 347,36 + 6*410,48 + 7/2*493,24 - 4*798,38 - 6*462,31 = -1430,8 KJ.mol-12°) Calculer DRH°398
On donne :
C°p,m(C2H6,g) = 53,1 J mol.-1 K-1
C°p,m(O2,g) = 29,47 J mol.-1 K-1
C°p,m(CO2,g) = 37,24 J mol.-1 K-1
C°p,m(H2O,g) = 32,14 J mol.-1 K-1
On supposera C°p,m constant dans l'intervalle de température considérée.
D
RH0T = DRH0T0 + · DCp0 dT
D
Cp0 = S ni Cp0i = 2 Cp0CO2 + 3 Cp0H2O - Cp0C2H6 - 7/2 Cp0O2D
Cp0 = 2* 37,24 + 3*32,14 -53,1-7/2*29,47 = 14,655 J.mol-1 K-1·
14,655 dT = 14,655*(398-298) = 1465,5 J.mol-1D
RH0398 = -1430800 + 1465,5 = -1429334,5 = -1429,3 KJ.mol-1D
RH0 varie très peu avec la température.
Exercice 4:
2 SO2 (g) + O2 (g) = 2 SO3 (g)
Calculer la constante KR de l'équilibre à la température de 25°C.
|
|
SO2(g) |
O2 (g) |
SO3 (g) |
D f G°298 (kJ.mol.-1) |
- 300,37 |
0 |
- 370,37 |
D
RG0 = S ni DRGf0iD
RG0 = 2*- 370,37 - 2*-300,37 - 0 = -140 KJ.mol-1D
RG0 = -R T ln K è K = exp(-DRG0/RT) = 3,47 1024
Exercice 5 :
Soit la réaction :
A(g) + 2 B(g) = C(s)
On donne pour cette réaction les valeurs de KR pour 4 températures :
|
T (K) |
KR |
|
300 |
35608 |
|
500 |
996 |
|
1000 |
68 |
|
2000 |
18 |
1) Déterminer DRG0300
2
) Déterminer DRH0 et DRS0 en supposant qu'elles sont indépendantes de la température.1) D
RG0 = - R T ln K = -8,314*300*ln35608 = -26140 J.mol-12) DRG0 = DRH0 - TDRS0 = - R T ln K
- D
RH0 / R T + DRS0 / R = ln KSi on porte ln K = f (1 / T) on obtient une droite de pente P = - DRH0 / R et d'ordonnée à l'origine O = DRS0 / R
|
KR |
T (K) |
1/T |
ln K |
|
35608 |
300 |
0,003333 |
10,4803 |
|
996 |
500 |
0,002 |
6,904 |
|
68 |
1000 |
0,001 |
4,220 |
|
18 |
2000 |
0,0005 |
2,890 |
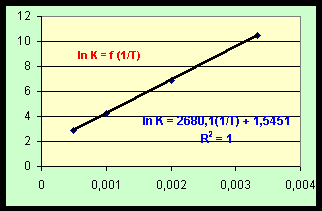
P = - DRH0 / R è DRH0 = - P * R
P = 2680,1 è DRH0 = -22281,5 J.mol-1
O =
DRS0 / R è DRS0 = O * RO = 1,541
è DRS0 = 12,8 J.mol-1K-1Exercice 6
On étudie la réaction suivante : A(g) + B(s) = 2 C(g)
Pour diverses températures on a déterminé la constante K de cet équilibre. On a trouvé les valeurs suivantes :
|
T (° C) |
K |
|
27 |
0,018 |
|
127 |
0,222 |
|
327 |
2,725 |
1
) Prévoir sans calculs et en justifiant simplement votre réponse :a) le signe de DRH0
On voit que K augmente quand T augmente
Principe de Le Chatelier : Réaction endothermique et donc DRH0 > 0
Loi de Vant'hoff : d ln K / dT = DRH0 / RT2
d ln K et dT ont même signe puisqu'il varient dans le même sens. { d ln K / dT } > 0
RT2 est positif donc DRH0 > 0 et réaction endothermique.
b) le signe de DRS0
A(g) + B(s) = 2 C(g)
L'augmentation du nombre de mole gazeuse fait augmenter le désordre et donc
DRS0 > 0.2) Déterminer les valeurs de DRH0 et DRS0
On pourrait comme précédemment faire une résolution graphique.
On peut plus rapidement se contenter d'utiliser deux points seulement.
|
T (K) |
K |
1/T |
lnK |
|
300 |
0,018 |
0,003333 |
- 4,01738 |
|
600 |
2,725 |
0,001666 |
1,00246 |
P = Dy / Dx = (-4,0174 - 1,0025) / (0,003333 - 0,001666) = -3011
O = y - Px = -4,0174 + 3011 * 0,00333 = 6,009
Soit
DRH0 = - P * R = 3011 * 8,314 = 25036 J.mol-1Et DRS0 = O * R = 6,009 * 8,314 = 49,96 J.mol-1.K-1
3) On appelle température d'inversion d'un équilibre la température pour laquelle sa constante est égale à l'unité. Déterminer la température d'inversion de cet équilibre.
D
RG0 = DRH0 - TDRS0 = - R T ln K = - R T ln 1 = 0D
RH0 = T DRS0T = DRH0 / DRS0 = 25036 / 49,96 = 501 K (soit 228 °C)
4) Prévoir qualitativement l'influence d'une augmentation de pression sur cet équilibre.
A(g) + B(s) = 2 C(g)
Le nombre de mole gazeuse augmente au cours de la réaction.
Principe de Le Chatelier : L'équilibre s'oppose à l'augmentation de pression en se déplaçant dans le sens de diminution du nombre de mole gazeuses = Sens 2 = dissociation de C en A et B
5) Prévoir qualitativement l'influence à pression constante :
D
G = DG0 + RT ln Q = -RT ln K + RT ln Q = RT ln (Q / K )K ne dépend que de T, il suffit de regarder comment Q varie pour prévoir dans quel sens l'équilibre se déplace.
On suppose que T est maintenue constante.
A(g) + B(s) = 2 C(g)
Q = aC2 / { aA aB }
aC = PC aA = PA aC = xC = 1
Q = PC2 / PA = [ nC2 P2/ nt2 ] * [ nt / nA P ] = nC2 P / ( nA nt )
L'ajout de A fait augmenter nA et nt ce qui fait diminuer Q et donc DG, si on suppose que l'on était à l'équilibre DG devient négatif et l'équilibre se déplace donc dans le sens 1 de formation de C.
Q = nC2 P / ( nA nt )
attention : nt est le nombre total de mole gazeuses
B est un solide, Q ne dépend pas de nB il n'y donc aucun effet sur l'équilibre.
Q = nC2 P / ( nA nt ) (avec P et nA constants)
Q = nC2 / nA * P /nt = cte * nC2 / nA
Q va augmenter car le terme nC2 du numérateur augmente plus rapidement que le terme nt (= nA + nC) du dénominateur. La fonction représentant Q est une parabole croissante car nA et nC qui sont des nombre de moles sont forcément positifs. DG va donc augmenter, si on suppose qu'on était à l'équilibre au moment de l'ajout du C supplémentaire on voit que DG devient positif. L'équilibre se déplace donc dans le sens 2.
Exercice 7 :
On donne E0 Fe3+/Fe2+ = 0,77 V et E0 Fe2+/Fe = -0,44 V. Calculer E0 Fe3+/Fe
(1) Fe3+ + e- =Fe2+ E01
(2) Fe2++ 2 e- =Fe E02
(3) Fe3+ + 3e- = Fe E03
(3) = (1) + (2)
D
G03 = DG01 + DG02-3 F E03 = - F E01 + - 2 F E02
3 E03 = E01 + 2 E02
E03 = ( E01 + 2 E02 ) / 3 = (0,77 + 2
* -0,44 ) / 3 = -0,037 VExercice 8 :
C=12 H=1 O=16
On étudie l’équilibre d’estérification entre l’acide éthanoïque (CH3COOH) et le méthanol (CH3OH) qui fournit de l’éthanoate de méthyle (CH3COOCH3) et de l’eau.
- Ecrire l’équilibre correspondant.
- Lors d’une expérience, on mélange 6 g d’acide éthanoïque pur et 3,2 g de méthanol pur. On laisse la réaction se faire jusqu’a ce que l’équilibre soit établi. On analyse alors le mélange réactionnel et on trouve qu’il s’est formé 0,07 mole d’eau. Calculer la constante de cet équilibre.
- Lors d’une autre expérience on fait réagir 10 g d’acide éthanoïque pur et 20g de méthanol pur. Quelle sera la composition du mélange à l’équilibre ?
Ecrire l’équilibre correspondant.
CH3COOH (l) + CH3OH(l) = CH3COOCH3 (l) + H2O(l)
* Lors d’une expérience, on mélange 6 g d’acide éthanoïque pur et 3,2 g de méthanol pur. On laisse la réaction se faire jusqu’a ce que l’équilibre soit établi. On analyse alors le mélange réactionnel et on trouve qu’il s’est formé 0,07 mole d’eau. Calculer la constante de cet équilibre.
|
|
CH3COOH (l) |
CH3OH(l) |
CH3COOCH3 (l) |
H2O(l) |
|
Etat initial |
0,1 |
0,1 |
0 |
0 |
|
Etat final |
0,1 - x |
0,1 - x |
x |
x |
Etat initial :
nCH3COOH = 6 / ( 24+4+32) = 6 / 60 = 0,1 mole
nCH3OH = 3,2 / ( 12+4+16 ) = 3,2 / 32 = 0,1 mole
Etat final :
nH2O = n CH3COOCH3 = x = 0,07 mole
nCH3COOH = nCH3OH = 0,1 - 0,07 = 0,03 mole
KR = a H2O(l) aCH3COOCH3 (l) / { aCH3COOH(l) aCH3OH(l) }
Les activités des liquides sont leurs fractions molaires dans leurs phases respectives.
On suppose en l'absence d'indications particulières que tous ces liquides sont miscibles entre eux dans les conditions de l'expérience et qu'on n'a donc qu'une seule phase.
Nombre total de mole : nt = 0,07 + 0,07 + 0,03 + 0,03 = 0,2 mole
aH2O = aCH3COOCH3 = 0,07 / 0,2 = 0,35
aCH3COOH = aCH3OH = 0,03 / 0,2 = 0,15
KR = 0,352 / 0,152 = 5,444
Lors d’une autre expérience on fait réagir 10 g d’acide éthanoïque pur et 20g de méthanol pur. Quelle sera la composition du mélange à l’équilibre ?
|
|
CH3COOH (l) |
CH3OH(l) |
CH3COOCH3 (l) |
H2O(l) |
|
Etat initial |
0,167 |
0,625 |
0 |
0 |
|
Etat final |
0,167 - x |
0,625 - x |
x |
x |
Etat initial :
nCH3COOH = 10 / ( 24+4+32) = 10 / 60 = 0,167 mole
nCH3OH = 20 / ( 12+4+16 ) = 20 / 32 = 0,625 mole
KR = a H2O(l) aCH3COOCH3 (l) / { aCH3COOH(l) aCH3OH(l) }
5,444 = x2/((0,167-x)(0,625-x))
Le nombre total de mole se simplifie.
5,444 (0,167-x) (0,625-x) = x2
5,444 x2 - 4,312 x + 0,5682 = x2
4,444 x2 - 4,312 x + 0,5682 = 0
D = 4,3122 - 4*4,444*0,5682 = 8,493
Ö D
= 2,914x1
= (4,312 + 2,914) / (2*4,444) = 0,813 molex2
= (4,312 - 2,914) / (2*4,444) = 0,157 moleOr
x est obligatoirement inférieur à 0,167 mole on ne garde donc que la solution physiquement possible : x = 0,1573n CH3COOH = 0,0097 mole
n CH3OH = 0.4677 mole
n CH3COOCH3 = n H2O = 0,1573 mole
On peut vérifier que le nombre de mole total est bien égal à sa valeur initiale
0,1573 + 0,1573 + 0.0097 + 0,4677 = 0,792 = 0,167 + 0,625
Ou recalculer K = 0,15732/0,0097/0,4677=5,45 (proche de la valeur exacte aux arrondis près)
- Lors d’une troisième expérience on mélange 1 mole d’éthanoate de méthyle et 36 g d’eau. Quelle sera la composition du mélange à l’équilibre ?
|
|
CH3COOH (l) |
CH3OH(l) |
CH3COOCH3 (l) |
H2O(l) |
|
Etat initial |
0 |
0 |
1 |
2 |
|
Etat final |
0 - x |
0 - x |
1 + x |
2 + x |
KR = a H2O(l) aCH3COOCH3 (l) / { aCH3COOH(l) aCH3OH(l) }
5,444 = (1 +
x) (2 + x)) / x2Le nombre total de mole se simplifie.
5,444 x2 = (1 + x) (2 + x)
5,444 x2 = x2 + 3x + 2
4,444 x2 - 3 x - 2 = 0
D = 32 + 4*4,444*2 = 44,55
Ö D
= 6,675x1
= (3 + 6,675) / (2*4,444) = 1,089 molex2
= (4,312 - 2,914) / (2*4,444) = -0,413 moleOr
x est obligatoirement négatif et on ne garde donc que x = -0,413n CH3COOH = 0,413 mole
n CH3OH = 0,413 mole
n CH3COOCH3 = 0,5865 mole
n H2O = 1,5865 mole
On peut vérifier que le nombre de mole total est bien égal à sa valeur initiale
0,413 + 0,413 + 0,5865 + 1,5865 = 2,999 = 1 + 2
Ou recalculer K = (0,5865 * 1,5865 ) /0,4132 =5,45 (proche de la valeur exacte aux arrondis près)
Exercice 9
:A partir des constantes d’équilibre connues calculer les constantes d’équilibre inconnues.
(1) A + B = 2C (K1 = 10)
(2) B + 2D = E (K2 = 0,5)
(3) E + 2A = 2F (K3 = 1,5)
(4) 2B = E (K4 = 25)
(5) A + 2D = 2C (K5 = ?)
(6) 2D + A = F (K6 = ?)
(7) A + B = F (K7 = ?)
(5) A + 2D = 2C (K5 = ?)
(5) = (1) + (2) - (4)
A + B + B + 2D + E = 2C + E + 2B
A + 2D = 2C
D
RG05 = DRG01 + DRG02 - DRG04-RT ln K5 = -RT ln K1 - RT ln K2 + RT ln K4
ln K5 = ln K1 + ln K2 - ln K4
K5 = K1 * K2 / K4 = 10*0,5/25 = 0,2
(6) 2D + A = F (K6 = ?)
2*(6) = 2*(2) - (4) + (3)
2 B + 4 D + E + E + 2A = 2 E + 2B + 2F
4 D + 2A = 2F
2 D
RG06 = 2 DRG02 - DRG04 + DRG03-2 RT ln K6 = - 2 RT ln K2 + RT ln K4 - RT ln K3
2 ln K6 = 2 ln K2 - ln K4 + ln K3
K62 = K22 K3 / K4 =0,52 * 1,5 / 25 = 0,015
(7) A + B = F (K7 = ?)
(7) = (1) - (5) + (6)
A + B + 2C + 2D + A = 2C + A + 2D + F
B + A = F
D
RG07 = DRG01 - DRG05 + DRG06- RT ln K7 = - RT ln K1 + RT ln K5 - RT ln K6
ln K7 = ln K1 - ln K5 + ln K6
K7 = K1 * K6 / K5 = 10 * 0,015 / 0,2 = 0,75