CORRIGES DES EXERCICES SUR LES MOLECULES
MODELE DE LEWIS - METHODE V.S.E.P.R
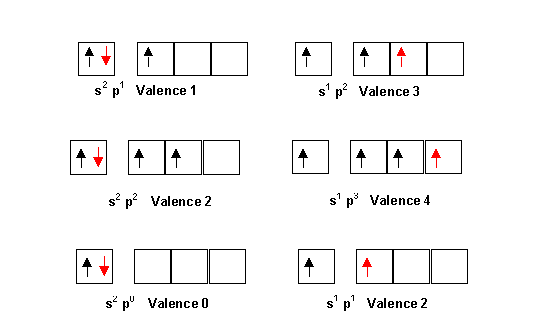
La prévision a priori des formules se fait dans les cas les plus simples en se basant sur la notion de valence des éléments. La valence correspond le plus souvent au nombre d'électron célibataire présent sur la couche de valence de l'élément étudié. Dans le modèle de Lewis se sont ces électrons célibataires qui formeront le plus souvent les liaisons chimiques en s'associant avec un autre électron célibataire d'un autre atome. Le doublet ainsi constitué formant la liaison chimique. Il faut toutefois tenir compte de la possibilité d'excitation des atomes, qui peut modifier la valence de ceux-ci. Ainsi les configurations électroniques de type s2 p1 a un seul électron célibataire pourront facilement se transformer en s1 p2 a trois électrons célibataires. La valence passant alors de 1 à 3. De même les configurations en s2 p2 de valence 2 conduiront facilement à la valence 4 par excitation en s1 p3. Enfin les configuration en s2 de valence 0 pourront par excitation en s1 p1 conduire à la valence 2. Il existe encore d'autres types d'excitations qui seront envisagées plus loin.

Compte tenu de ces diverses possibilités on peut résumer les valences courantes des éléments à partir de leur place dans la classification. Soit le tableau suivant. Pour les éléments courants dont la position doit être parfaitement connue.
En rouge est indiquée la valence "normale" la plus fréquemment rencontrée.
| Configuration | s1 |
s2 |
p1 |
p2 |
p3 |
p4 |
p5 |
p6 |
| Valence courante | 1 |
0 ou 2 |
1 ou 3 |
2 ou 4 |
3 |
2 |
1 |
0 |
H |
He |
|||||||
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
|
K |
Ca |
Br |
Kr |
|||||
I |
Xe |
|||||||
Rn |
Ici nous envisageons des molécules hydrogénées de divers éléments, les formules seront déduites simplement par la valence de l'élément lié à H puisque celui-ci a la valence 1.
LiH - NaH - CH2 ou CH4 - SiH2 ou SiH4 - NH3 - OH2 - SH2 - ClH
Le Néon gaz inerte de valence 0 ne donnera pas de composés stables.
On remarque bien entendu que les éléments appartenant à une même colonne donneront un composé de même type, cela est tout à fait normal puisque ayant même configuration leurs propriétés chimiques sont très proches (notion de famille ou groupe chimique).
Nous allons utiliser cette propriété pour prévoir facilement le composé hydrogéné de As dont la position dans la classification n'est pas obligatoirement connue. Il suffit de chercher sa configuration électronique. En utilisant la règle de Klechkowski on obtient :
As Z = 33 = 18 + 15 = (Ar) 3d10 4s2 4p3
Cette configuration le place dans la colonne de l'azote et on aura donc AsH3.
2) Nous avons vu que le carbone pouvait avoir les valences 2 ou 4. L'oxygène ne possède lui que la valence 2. On pourra donc obtenir CO (monoxyde de carbone) ou CO2 (dioxyde de carbone). Les schémas de Lewis moléculaires se déduisent facilement de ceux des atomes.
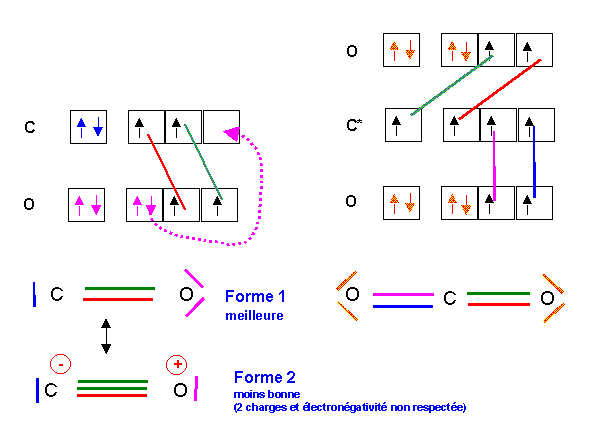
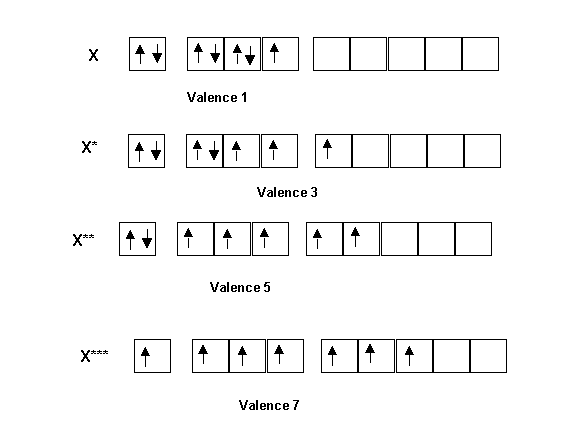
Br, F et I sont tous trois des halogènes de configuration s2 p5. Ils devraient donc à priori avoir des propriétés similaires et par conséquent donner des molécules de même type. Pour justifier les différences constatées, on va faire appel à nouveau à la notion d'excitation des atomes, nous ferons ici intervenir ici les cases quantiques vides des niveaux d. Pour pouvoir les faire intervenir encore faut-il qu'elles existent ce qui n'est possible qu'a partir de la troisième couche (n=3). Le Fluor appartenant à la deuxième période ne possède pas de niveau d, alors que l'Iode ou le Brome en possèdent. Ces deux atomes pourront être excités pour conduire à des valences plus élevées leur permettant de faire davantage de liaisons. Ainsi F ne possède que la valence 1 alors que I et Br possèdent les valences 1, 3, 5 et 7 selon leurs degrés d'excitation. On comprend donc pourquoi BrF3, BrF5 et IF7 peuvent exister alors que FBr3, FBr5 ne le peuvent pas. Reste à expliquer le fait que BrF7 n'existe pas alors qu'il semble théoriquement possible Br pouvant posséder la valence 7 nécessaire pour former ce composé. La raison de cette inexistence tient à des considérations d'encombrement stérique. L'atome de Brome est plus petit que l'atome d'iode et s'il est possible de placer 7 atomes de Fluor autour d'un atome d'iode, il n'est pas possible de faire de même autour de l'atome de Brome. Cela explique que IF7 existe alors que BrF7 n'existe pas.
Nous allons utiliser les diverses techniques vues dans le cours pour déterminer la structure de Lewis moléculaire, nous en déduirons ensuite la géométrie par utilisation de la méthode V.S.E.P.R.
BF3 - SO32- - POCl3 - ClO3- - SF5- - ClF3 - I3- - PCl4F - ClNO
"Matériaux" de départ : 1 atome de Bore et 3 atomes de Fluor
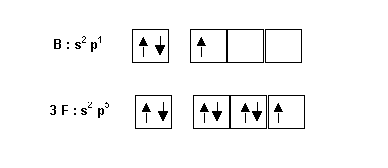
Il s'agit maintenant de construire la molécule en formant des liaisons covalentes par mise en commun de doublets d'électrons.
On excite l'atome de Bore de manière à obtenir la valence 3, puis on forme 3 liaisons de covalence normale avec les 3 atomes de Fluor.
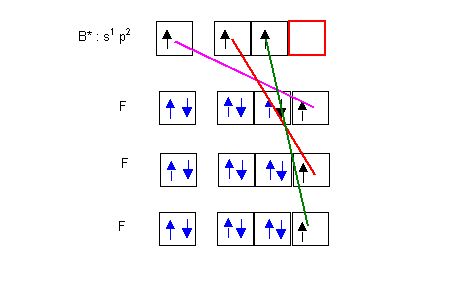
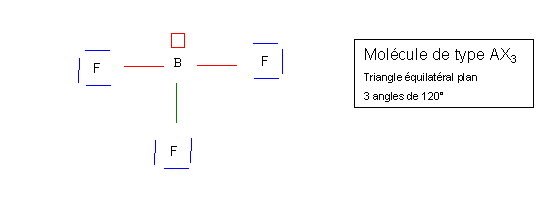
On obtient alors le schéma de Lewis de la molécule.
Il existe ici plusieurs manières de construire la molécule. Nous allons en envisager quelques-uns une. Nous verrons que ces diverses constructions ne sont pas toujours équivalentes mais que l'on peut passer facilement des unes aux autres par des déplacements de doublets électroniques. On parlera de formes de résonance ou mésomères.
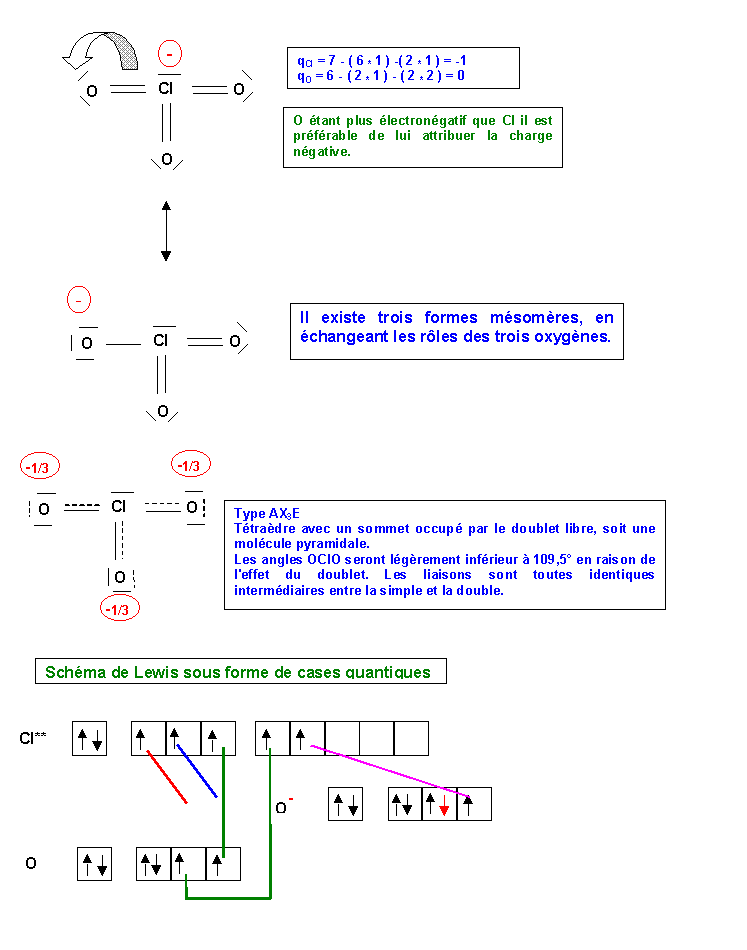
Première manière
Nous allons attribuer un électron supplémentaire a 2 atomes d'oxygène. L'oxygène étant très électronégatif, cela est logique. Pour obtenir ensuite une valence 4 pour l'atome de Soufre nous l'exciterons une fois. Il ne restera plus qu'a former une liaison de covalence normale par appariement des électrons célibataires.
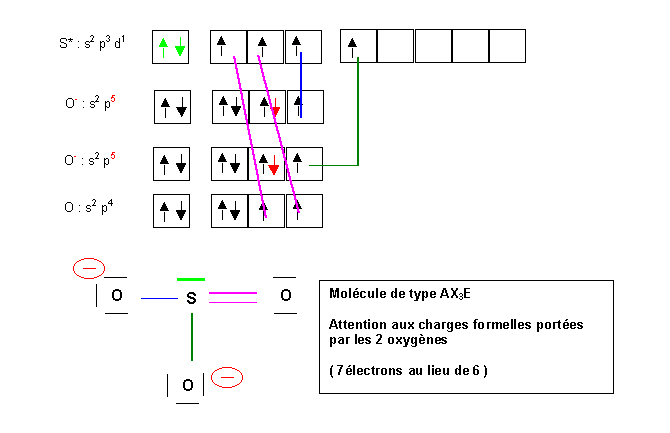
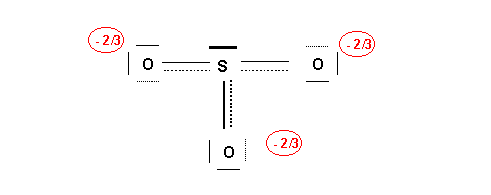
En réalité les trois atomes d'oxygène sont indiscernables, les trois liaisons S-O sont identiques. On traduit ce fait par l'écriture de trois formes de Lewis équivalentes dans lesquelles la liaison double se trouve tour a tour dans les trois positions possibles. Dans le même temps les charges formelles se déplacent elles aussi. On dit que l'on a affaire à trois formes mésomères. Le passage d'une forme à l'autre se fait par le déplacement de doublets électroniques.
Soient les schémas suivants :
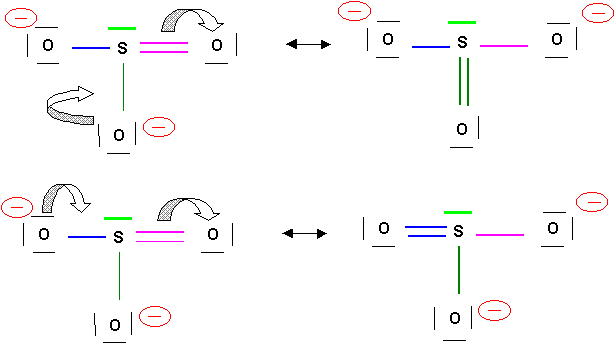
La molécule réelle sera un hybride de résonance intermédiaire entre ces trois formes
La géométrie de la molécule sera AX3E, la figure de répulsion associée est le tétraèdre. Le doublet libre occupera un des sommets du tétraèdre, la molécule sera donc pyramidale avec des angles proches de 109,5°. L'angle réel sera légèrement inférieur à 109° car le doublet libre est plus "encombrant" que les doublets de liaison, il est situé plus près de l'atome central et présentera une répulsion plus importante. L'angle OSO diminuera donc. En pratique l'angle sera tout de même très proche de 109,5° car les trois liaisons intermédiaires entre la simple et la double liaison sont elles aussi fortement répulsives en raison de leur charge élevée (1,5 doublets électroniques en moyenne).
Deuxième manière
Nous allons ici attribuer un électron supplémentaire à 1 atome d'oxygène, et le deuxième à l'atome de soufre dans une de ses cases d vide. (L'oxygène étant très électronégatif, cela n'est pas très logique, mais on est tout de même libre de le faire). L'atome de Soufre a alors la valence 3. Pour avoir 3 électrons célibataires sur les atomes d'oxygène nous allons en exciter un en appariant deux de ces électrons célibataires. On obtient ainsi un doublet et une case vide. Il ne reste plus qu'a former 3 liaisons de covalence normale par appariement des électrons célibataires et une liaison dative entre un doublet du soufre et la case vide de l'oxygène.
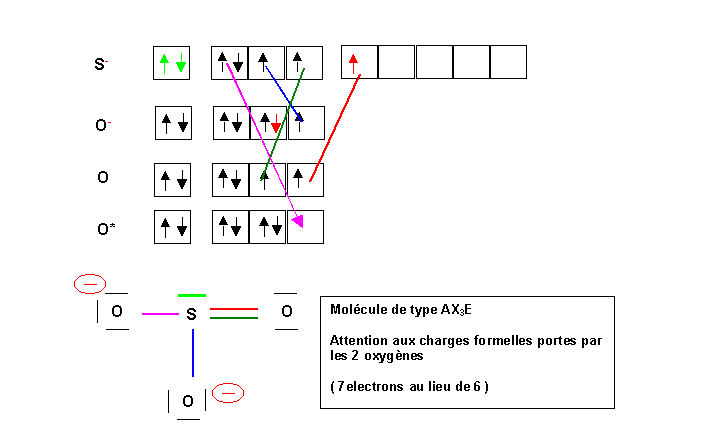
Malgré un traitement apparemment très différent du problème on obtient exactement le même résultat que précédemment. Dans le cadre du modèle simple de Lewis on a généralement toute liberté pour construire ces liaisons. Le résultat final ne sera le plus souvent pas modifie, on pourra néanmoins obtenir parfois des formes mésomères "exotiques" très peu représentative de la molécule réelle. Le bon sens et quelques règles simples guiderons le choix de la méthode de construction la plus adéquate.
Méthode Rapide :
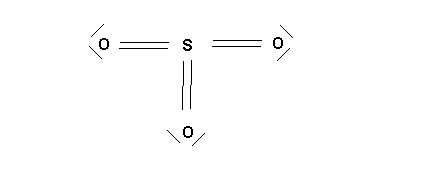
On peut aussi déterminer directement la structure de Lewis par utilisation de la méthode rapide vue en cours.
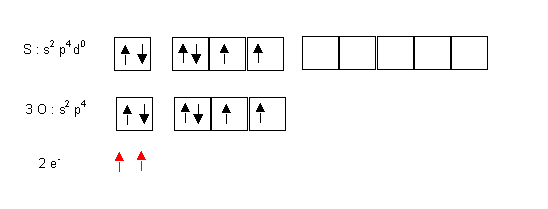
On suppose que l'atome central utilise tous ses électrons de valence : ici N = 6
On ajoute (ou enlève) les charges pour les ions moléculaires : ici q = 2
On obtient ainsi le nombre total d'électrons affecté a l'atome central : ici 6 + 2 = 8 électrons pour S
On suppose que les atomes latéraux forment des liaisons par leurs électrons célibataires, ici O fera des doubles liaisons puisqu'il possède 2 électrons célibataires.
On construit un schéma de Lewis provisoire :
On compte les électrons de l'atome central engagé dans des liaisons : ici 6 électrons
La différence entre le nombre total d'électrons de l'atome central et le nombre d'électrons engagé dans des liaisons représente le nombre d'électrons de l'atome central présent sous forme de doublets libres.
Ici 8 - 6 = 2 électrons soit 1 doublet libre.
On fait figurer les doublets libres sur le schéma de Lewis provisoire.
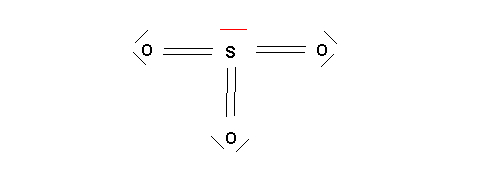
Il ne reste plus qu'a calculer et faire apparaître les éventuelles charges formelles.
q = n - l - 2e
n = nombre d'électron de l'atome isolé
l = nombre de liaison
e = nombre de doublets libres
qS = 6 - 6 - ( 2 * 1) = -2
qO = 6 - 2 - ( 2 * 2 ) = 0
On peut aussi tout simplement compter les électrons entourant chaque atome dans la molécules en partageant équitablement les doublets de liaison puis le comparer au nombre d'électrons de l'atome isolé :
Ici O possède 6 électrons dans la molécule. Il en possède aussi 6 dans l'atome isolé. Il n'a donc ni perdu, ni gagné d'électrons et sa charge formelles sera nulle.
S possède 8 électrons dans la molécule, l'atome isolé en possède 6, il à donc gagné deux électrons et sa charge formelle est -2.
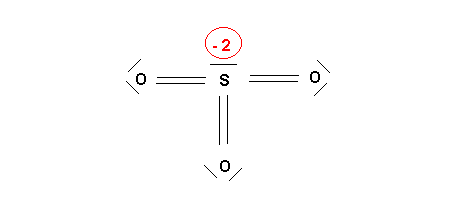
La forme mésomère ainsi obtenue sera corrigée pour améliorer son poids statistique en procédant à des déplacements électroniques judicieusement choisis.
Ici on va déplacer les deux charges négatives de S pour les distribuer sur deux des atomes d'oxygène.
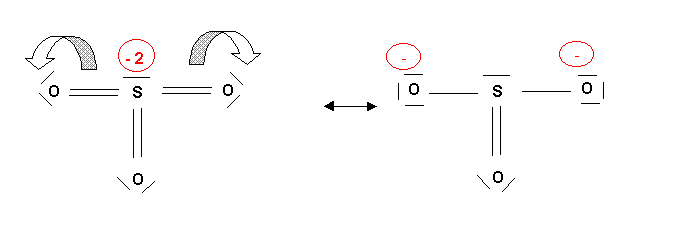
Méthode rapide :
Cl : 7 électrons
Charge : 1 électron
Total pour Cl : 8 électrons
O : 2 électrons célibataires soit une double liaison
3 O donc 6 liaisons autour de Cl
6 électrons de Cl servent à faire les 6 liaisons, il lui reste donc 8 - 6 = 2 électrons non engagés dans des liaisons, soit un doublet libre pour Cl.
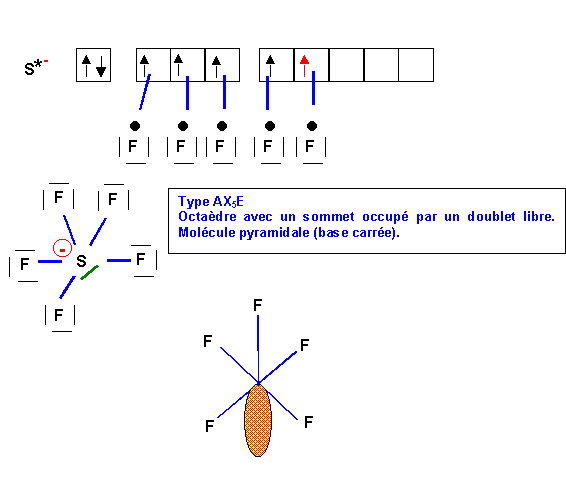
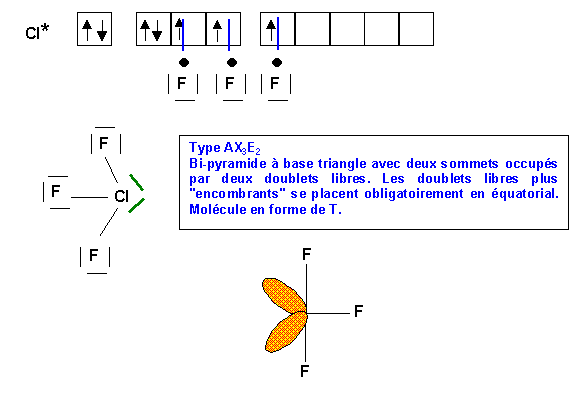
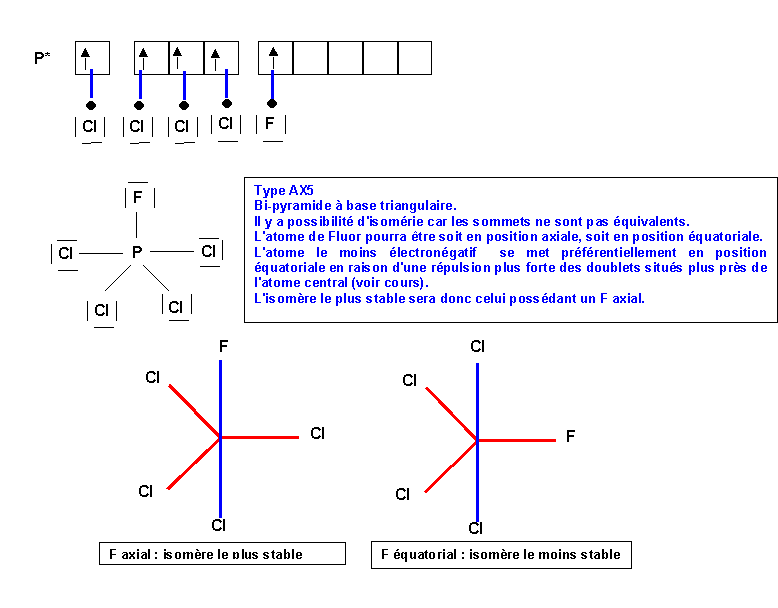
Méthode rapide :
I central : 7 e-
Charge négative : 1 e-
Soit 8 e- au total pour le I central
I latéral : 1 e- célibataire soit une simple liaison
L'atome central fait donc deux liaisons, il lui reste 8 - 2 = 6 e-, soit 3 doublets libres

Remarque :
On trouverai le même résultat en considérant la taille des atomes latéraux. L'atome le plus gros se place en position équatoriale, là ou il dispose de plus de place en raison des angles de 120°. Rappelons qu'en première approximation, le rayon atomique varie comme n2/Z*. Dans une même famille Z* augmente légèrement en descendant la colonne, simultanément n augmente d'une unité a chaque période. L'effet de l'augmentation de n2 l'emporte et le rayon atomique augmente en descendant dans la colonne. Cl est donc plus volumineux que F et se placera donc préférentiellement en position équatoriale. Comme l'électronégativité d'Alred et Rochow varie comme Z*/R2 l'atome le plus petit est donc aussi le plus électronégatif et on trouve donc le même résultat que l'on considère l'électronégativité ou le rayon de l'atome latéral. Il est tout de même préférable de raisonner en terme d'électronégativité car la méthode V.S.E.P.R comme son nom l'indique repose sur la répulsions des doublets de la couche de valence et non sur la taille des atomes liés à l'atome central.
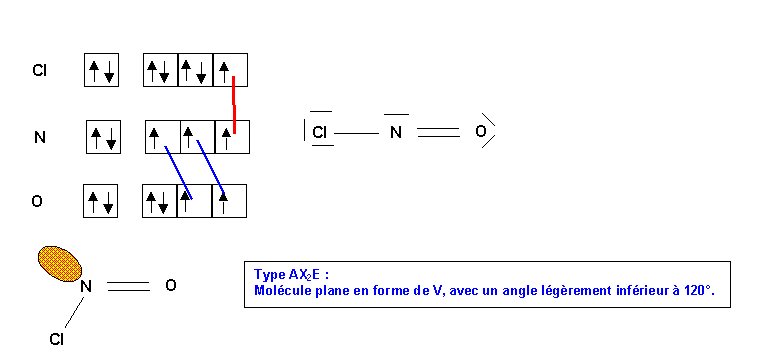
Méthode rapide :
C central : 4 électrons + 1électron de charge = 6 électrons
3 O latéraux * 2 électrons célibataires => 3 doubles liaisons => 6 liaisons pour C
6 électrons et 6 liaisons => C ne possède pas de doublets libres.
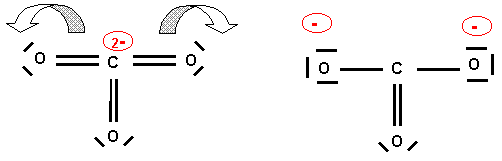
Il existe trois formes mésomères équivalentes en échangeant le rôle des oxygènes.
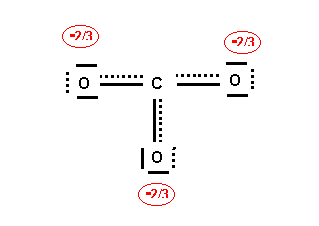
La molécules est du type AX3 avec une symétrie parfaite. Triangle équilatéral plan avec des angles de 120 ° exactement. Les trois liaisons sont identiques et intermédiaires entre la simple et la double liaison. On peut le vérifier par le calcul approché des longueur de liaisons :
C Z* = 3,25 et n* = 2
O Z* = 4,55 et n* = 2
LCO = 0,239 * (4/3,25 + 4/4,55) + ( 0,164 * 4 ) + 0,297 = 1,457 A°
Simple : 1,457 A°
Double : 0,86 * 1,457 = 1.24 A°
Triple : 0,78 * 1,457 = 1,12 A°
La longueur de liaison expérimentale de 1,29 A° est bien comprise entre la longueur de la simple liaison et celle de la double liaison.
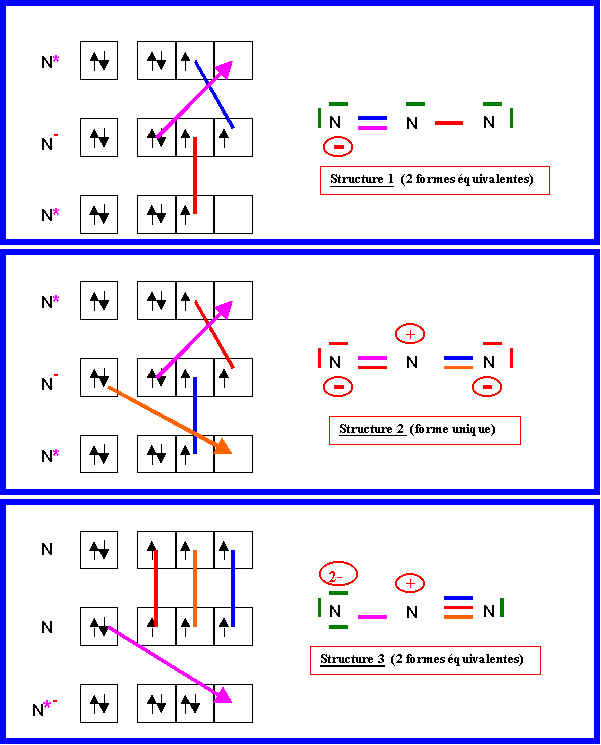
La structure 1 présente une géométrie de type AX2E. Les structures 2 et 3 sont de type AX2.
La longueur de liaison est intermédiaire entre la double et la triple si on la calcule avec la formule approchée. Z* = 3,9 et n* = 2 pour N => Simple : 1,44 A° - Double : 1,24 A° - Triple : 1,12 A°
Si on regarde les formes mésomère la liaison N-N est tantôt simple, tantôt double et tantôt triple.
Bien que d'un poids statistique à priori plutôt faible en raison d'une moins bonne répartition des charges, la forme 3 présente l'avantage d'exister sous deux formes équivalentes ce qui multiplie son poids statistique par 2. Cette forme n'est donc pas négligeable et la liaison est raccourcie par la présence de la triple liaison dans cette forme. On peut aussi considérer que la forme 2 présente un azote positif encadré par deux azotes négatifs, il va donc y avoir une forte attraction entres ces atomes chargés de même signe et il est donc normal que la liaison soit raccourcie par effet de polarité. La structure 1 qui est peu chargée semble être satisfaisante à ce point de vue mais elle présente l'inconvénient de ne pas suivre la règle de l'octet pour un des atomes (simple liaison), l'atome d'Azote appartenant à la deuxième période la règle de l'octet est prioritaire et cette structure doit donc avoir tout de même un poid statistique faible. La géométrie de la molécule réelle est bien linéaire ce qui confirme ce fait.
Notons enfin que cette molécule est instable et il est donc normal que le modèle simple de Lewis ait du mal à la décrire. L'ion azoture libère N2 par sa destruction, cela est utilisé dans les systèmes "airbag", sous l'effet du choc l'ion azoture est détruit et libère N2 qui va gonfler l'airbag.