MOLECULES
L’atome dont le symbole est souligné est l’atome central
Les rayons de covalence des atomes seront évalués par la formule
R (A°) = 0,215 (n*2/Z*) + 0,148 n* + 0,225
(avec n*=n pour n=2 ou n=2 ; n*=3.6 pour n=4 et n*=4 pour n=5
Pour H on prendra RH = 0,346 A°
Les longueurs de liaisons (en A°) seront évaluées par la formule dA-B = 1,11 dCalc - 0,203
(dCalc = somme des rayons de covalence en A°)
ou plus simplement, sans passer par l’intermédiaire des rayons de covalence
L (A°) = 0,239 S (n*2/Z*) + 0,164 S n* + 0,297
Liaison double = 86 % de la simple - Liaison triple = 78% de la simple
Justification des formules utilisées : Voir Article du B.U.P
Modèle de Lewis - V.S.E.P.R - Mésomérie ( 8 exercices)
Electronégativité de Pauling - Liaisons Polarisées - Moments dipolaires (5 exercices)
Intéractions de faibles énergies (2 exercices)
Complexes des métaux de transition (1 exercice)
Notions quantiques (3 exercices)
Orbitales Atomiques - Hybridation (2 exercices)
Orbitales Moléculaires - Modèle C.L.O.A - O.M (3 exercices)
Mésomérie (1 exercice)
Structures de Lewis des molécules - Mésomérie
Prévision des géométries moléculaires par la méthode V.S.E.P.R
Exercice 1 :
1) Prévoir les formules des dérivés hydrogénés probables des éléments suivants :
Li - O - N - Cl - As(Z=33) - Si - Ne - C - S - Na
2) Le carbone donne deux composés différents avec l’oxygène CO et CO2.
Justifier l’existence de ces deux composés.
Exercice 2 :
Les composés BrF3 , BrF5 et IF7 existent alors que les composés FBr3 , FBr5 et BrF7 n’ont jamais pu être synthétisés. Justifier ces faits expérimentaux.
Exercice 3 :
Pour les molécules ou ions suivants :
a) Proposer une structure de Lewis.
b) Par application de la Méthode V.S.E.P.R déterminer la géométrie.
BF3 ; SO32- ; POCl3 ; ClO3- ; SF5- , ClF3 ; I3- ; PCl4F ; ClNO
Exercice 4 :
Donner la géométrie et la structure de Lewis de l'ion carbonate CO32-.
L'expérience montre que pour cet ion, toutes les liaisons CO sont équivalentes et de longueur 0,129 nm. Justifier ce résultat.
Exercice 5 :
L’ion azoture N3- bien que très instable, car explosif existe. Proposer une structure de Lewis pour cet ion et déduire sa géométrie. Les deux liaisons NN sont en fait identiques de longueur 1,15 A°. Justifier.
Exercice 6 :
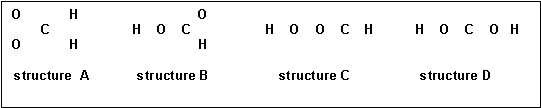
Soit la molécule de formule brute CH2O2 :
On peut envisager (entre autres) les enchaînements d’atomes suivants pour cette molécule :

1) Proposer pour chacun de ces enchaînements une structure de Lewis moléculaire.
On fera apparaître les divers types de liaisons (simples, doubles ou triples) ainsi que les éventuels doublets libres et/ou cases quantiques vides.
2) Donner dans chaque cas la géométrie prévue par la méthode V.S.E.P.R. On précisera la valeur prévue pour les divers angles de liaison.
3) A partir des valeurs des rayons de covalence des atomes C, H et O on estimera les diverses longueurs de liaisons dans chaque cas (formules données plus haut)
4) Cette molécule existe réellement, il s’agit de l’acide méthanoïque (ou formique) HCOOH (structure B) et on a pu déterminer expérimentalement les diverses longueurs de liaisons ainsi que les divers angles de liaisons. On a trouvé les résultats suivants :
Longueurs des liaisons ( A°) : 0,95 - 1,09 - 1,25 - 1,31 Angles de liaisons ( °) : 108 - 118 - 118 - 124
a) Attribuer les diverses longueurs de liaisons observées.
b) Pour une des liaisons l’accord entre valeur calculée et expérimentale est nettement moins bon que pour les autres.
De quelle liaison s’agit-il ?
Montrer qu’il est possible d’expliquer ce mauvais accord par l’existence d’une forme mésomère faisant intervenir un des doublet libres de l’atome d’oxygène.
Montrer d’autre part que l’intervention de cette forme mésomère permet d’expliquer l’acidité importante (pKa = 3,7) de l’acide formique.
Montrer de même que l’anion formiate HCOO- dont on donnera la structure de Lewis est fortement stabilisé par effet mésomère.
c) Attribuer les divers angles de liaison observés.
Exercice 7 :
Soit la molécule de formule brute C2H4O
On peut imaginer les enchaînements d'atomes suivants pour "construire" cette molécule :
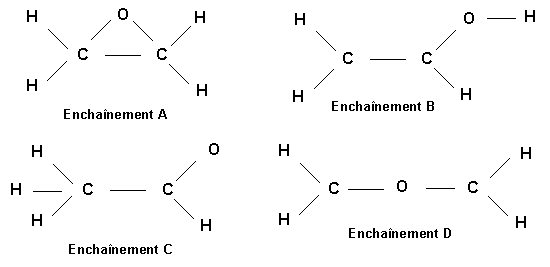
7-1) Pour les atomes impliqués montrer comment on peut déterminer la charge nucléaire effective Z*. On rappelle les valeurs des constantes d'écran de Slater : 0,35 (0,3) - 0,85 - 1
7-2) Pour chacun de ces enchaînements proposer une structure de Lewis.
7-3) Pour chaque structure de Lewis, préciser la géométrie :
7-3-a) Valeurs prévues pour les angles des liaisons
7-3-b) Valeurs prévues pour les différentes longueurs des liaisons
Les données expérimentales concernant cette molécule montrent qu'elle est constituée par l'enchaînement de six liaisons. Les six liaisons se répartissent en trois types seulement, de longueur respectives : 1,09 , 1,22 et 1,5 A°.
7-4) Montrer qu'une seule structure correspond à ces données.
7-5) Assigner a chaque liaison sa longueur par comparaison avec les valeurs calculées.
Exercice 8 :
La molécule de Dioxyde d’Azote NO2 possède un électron " célibataire "
1) Essayer de décrire cette molécule en utilisant le modèle de Lewis. On écrira deux structures de Lewis différentes où l’électron " célibataire " sera attribué à l’atome d’azote (structure A) ou à celui d’oxygène (structure B).
2) Montrer que la géométrie d’une de ces deux structures est facilement prévisible par la méthode V.S.E.P.R alors que l’autre ne l’est pas.
3) Cette molécule peut donner facilement un anion NO2- et un cation NO2+.
a) Quelles sont les structures de Lewis de ces deux ions ?
b) Expérimentalement on trouve des angles O - N - O de 180 ° pour l’un et 115 ° pour l’autre.
Attribuer à chaque ion son angle de liaison.
Justifier les écarts éventuels aux valeurs prévues par la théorie V.S.E.P.R.
4) Expérimentalement on a pu montrer que l’angle O-N-O était de 134 ° pour la molécule NO2.
a) Compte tenu des résultats précédents cet angle est-il justifiable ?
b) Montrer à partir de cette valeur de l’angle de liaison qu’une seule des structures de Lewis A ou B peut correspondre à la molécule réelle. Laquelle ?
5) La molécule NO2 se dimérise très facilement en N2O4. Justifier. Donner la structure de Lewis du dimère.
Electronégativité de Pauling - Liaisons Polarisées - Moments dipolaires
Exercice 1 :
Soient les énergies de dissociation suivantes en kJ mol-1
H2 435 ; F2 155 ; Cl2 242 ; HF 566 ; HCl 431
Déterminer les électronégativités selon Pauling des atomes F et Cl. On prendra X =2,2 pour H.
Exercice 2 :
Calculer les pourcentages ioniques des liaisons suivantes :
H ---- Cl m = 1,08 D d = 1,27 A°
H ---- Br m = 0,79 D d = 1,42 A°
H ---- I m = 0,38 D d = 1,61 A° (1 D = 0,333 10-29 C . m)
Exercice 3 :
La molécule SO2 a une géométrie en V ; l’angle des deux liaisons S-O est de 119°. Son moment dipolaire mesuré est de 1,65 D (1 D = 0,333 10-29 C . m). Donner la structure de Lewis de cette molécule. Montrer qu’on peut la décrire par deux structures mésomères obtenues soit en " excitant " S, soit en " excitant " O. La longueur de liaison expérimentale est de 1,43 A°. Comparer à la valeur calculée. Conclusion ? Calculer le pourcentage d’ionicité de ces liaisons. Calculer les charges partielles portées par chaque atome.
Exercice 4 :
Sachant que le moment dipolaire partiel de liaison mN-O est de 0.15 D :
a) calculer le moment dipolaire global de l’ion NO3-.
b) calculer le moment dipolaire global de la molécule NO2 (a = 134° voir précédemment).
Exercice 5 :
Une seule des trois molécules CO2 , CS2 et COS possède un moment dipolaire permanent.
Laquelle ? Pourquoi ? Quel est le sens de ce moment dipolaire ?
Intéractions de faibles énergies - Liaisons Hydrogène
Exercice 1 :
Le butane (gazeux sous 1 bar à 298 K) et l’acétone (liquide sous 1 bar à 298 K) ont des points d’ébullition et des points de fusion très différents bien qu’ils aient tous deux la même masse molaire.
Attribuer à chacun son point d’ébullition et son point d’ébullition.
Justifier les différences observées.
T1 = - 138 °C - T2 = - 0,5 °C - T3 = - 95°C - T4 = + 56°C
Exercice 2 :
On donne les masses molaires et les points d’ébullition des composés hydrogénés des éléments de la colonne 15 de la classification périodique : NH3, PH3, AsH3 et SbH3
| M (gmol-1) | Teb (°C) | |
| NH3 | 17 | -33 |
| PH3 | 34 | -87 |
| AsH3 | 78 | -55 |
| SbH3 | 181 | -17 |
Montrer que l’un des composés possède un point d’ébullition " anormal ". Lequel ?
Evaluer le point d’ébullition que devrait avoir " normalement " ce composé.
Justifier cette anomalie.
Complexes des métaux de transition
Décrire par un schémas de Lewis sous forme de cases quantiques les liaisons dans les complexes octaédriques suivants, prévoir leur moment magnétique (en magnétons de Bohr), donner l’hybridation de l’atome central :
Fe(H2O)63+ - Co(NH3)63+ - CoF63- - Fe(CN)63-
NH3 et CN- sont des ligands à champ fort - H2O et Cl- sont des ligands à champ faible.
Quelques notions quantiques - Ondes de De Broglie - Principe d’Heisenberg
Exercice 1 :
La limite des longueurs d’ondes décelables expérimentalement correspond au domaine des rayons g, soit à la valeur limite l = 10-14 m.
a) Calculer la longueur de l’onde associée à une balle de pistolet de masse 15 g qui se déplace à la vitesse de 270 ms-1. Cette onde est elle décelable ?
b) quelle vitesse devrait-on donner à cette balle pour que la longueur d’onde associée atteigne la valeur 10-14 m. Conclusion ?
c) Calculer la longueur d’onde associée à un électron se déplaçant à 50000 kms-1.
d) Calculer la longueur d’onde associée à un électron se déplaçant à 270 ms-1. Conclusion ?
Exercice 2 :
Dans le modèle atomique de Bohr, l’électron est supposé suivre une trajectoire circulaire de rayon R. Bohr a posé à priori la condition de quantification du moment cinétique m v R = n h / 2?. En utilisant la notion d’onde de De Broglie pour exprimer le caractère ondulatoire d'un électron sur une telle orbite de Bohr montrer qu’il est possible de retrouver la condition de quantification du moment cinétique. Pour cela on tiendra compte du fait que pour qu’une onde stationnaire puisse s’établir il ne faut pas que celle-ci puisse interférer avec elle même.
Exercice 3 :
a) Si l'on suppose que le rayon de l'orbite de Bohr a0 = 0,529 A° est connu à 1% près, calculer Dv incertitude sur la vitesse de l'électron de masse 9,1 10-31 Kg. Conclusion ?
b) Si l'on suppose que la position d'une bille de masse 1 g est connue au mm près, quelle est l'incertitude sur sa vitesse ? Conclusion ?
Recouvrement des Orbitales Atomiques - Hybridation des orbitales atomiques
Exercice 1 :
Pour l’atome de Carbone et l’atome d’Hydrogène donner la configuration électronique dans leur état fondamental. Représenter leur couche de valence avec le modèle des cases quantiques.
Représenter la " forme géométrique " de leurs orbitales atomiques de valence.
Quel composé devrait se former entre ces deux atomes si on considèrait simplement le recouvrement de leurs orbitales atomiques de valence dans leur état fondamental?
En réalité ce composé n’existe pas. Le composé le plus simple de ces deux atomes est le méthane de formule CH4. Expliquer la formation de ce composé. Quelle géométrie devrait avoir ce composé si on considerrait simplement le recouvrement des orbitales atomiques de valence de C et H ?
Quelle est la géométrie réelle du méthane ?
Quel type d’hybridation permet de le décrire correctement ?
Exercice 2 :
Décrire les liaisons, la géométrie et l’hybridation des atomes de carbone dans les molécules suivantes : CH2=CH2 , CH3OH , HCOOH , CH3CHO , CH2 =C=CH2
Orbitales Moléculaires - Modèle C.L.O.A - O.M -
Exercice 1 :
Dans les structures suivantes dénombrer les doublets liants s ou p les doublets non liants n, et les cases vides présents dans les couches de valence.
AlF4- - CCl2 - SiO2 - CH3-CH2+ - CH2=CH-CH=O - COCl2
Exercice 2 :
1) Laquelle des deux molécules possède la plus grande énergie de dissociation ?
a) Li2 ou Li2+ b) C2 ou C2+ c) F2 ou F2+
2) Dans la série O2 , O2+ et O2-
Quelle est la molécule dont l’énergie de dissociation est la plus élevée ? Pourquoi ?
3) Sachant que la molécule B2 est paramagnétique, montrer qu’il y a nécessairement interaction sp.
Exercice 3 :
La molécule de monoxyde d’azote NO est paramagnétique.
- Essayez de décrire cette molécule dans le modèle de Lewis.
- Ce modèle rend-il compte de son paramagnétisme ?
- Décrire cette molécule dans le modèle C.L.O.A - O.M.
(on supposera qu’il y a intéraction s-p)
-Ce modèle rend-il compte du paramagnétisme de cette molécule ?
- La distance N - O dans la molécule NO est 1,15 A°. Justifier cette valeur expérimentale.
- L’ionisation de NO en NO+ est assez facile. Justifier ce fait expérimental.
- Comparer les distances N -O dans NO et NO+.
Exercice 1 :
Donner les diverses formes limites de résonance des composés suivants :
Benzène - Nitrobenzène - Aniline - CH2=CH-CH=CH-CHO - CH2=CH-CH2-CH2 -CHO