Thème N°2 : Identification de quelques cations et de quelques anions - Dosages d’ions
Produits et Matériel :
Solutions à Identifier : Solutions 0,1 M de : NaCl, KCl, KI, Hg(NO3)2, Pb(NO3)2, NH4Cl, ZnSO4, Na2S2O3, CuSO4, Al2(SO4)3, AgNO3, FeCl3, FeSO4, NaBr, Na3PO4, Na2CO3, NaClO.
Reactifs : Solutions 0,1 M et 1 M de : HCl, NaOH, NH3, KI - Acide Sulfurique Concentre - Eau de Chaux - Solution Acidifiee de KMnO4 - Solution 0,1 M d'Acetate de Plomb - Solution 0,1 M de BaCl2 - Eau de Javel - Tetrachlorure de Carbone - Cuivre en Tournures - Acide Nitrique Concentre - Orthophenantroline - Solution 0,1 M de thiocyanate de potassium - Aluminon - Solution de Mercurithiocyanate de Potassium - Ethanol - Dithizone - Tampon Acetique - Formol - Solution de Na2S - Ammoniaque Concentre - Solution 0,1 M de Thiosulfate de Sodium -
Matériel : bain-marie (2) - Fil de Fer ou de Platine - Tubes a essais (24) - Portoirs (4) - Tube a degagement pour tube a essais (5) - Petits Bechers 100 ml (5) - Pipettes Compte-gouttes (10) - Papier Filtre - Papier pH -
Introduction :
L'identification des cations et des anions est un problème fondamental de la chimie analytique. La seule méthode utilisable a longtemps été leur identification par voix chimique à l'aide de tests. Cette technique longue et difficile est maintenant supplantée par des méthodes physiques telles que la spectrophotométrie de flamme ou l'électrophorèse. Elle reste néanmoins tres intéressante d'un point de vue pédagogique car elle illustre bien les lois de la chimie générale : précipitation, complexation, oxydoréduction, pH et réactions acide-base etc. Nous allons ici nous cantonner à l'identification d'un nombre limité d'ions mais nous allons essayer de rendre cette démarche la plus rigoureuse possible. Ainsi, nous n'utiliserons pas par exemple la coloration des solutions, critère qui peut orienter la recherche, mais qui peut aussi être source d'erreur. Bien entendu et pour simplifier le problême, nous n'utiliserons pas de solutions contenant à la fois plusieurs cations ou plusieurs anions. Enfin, nous utiliserons une technique courante dans toutes les sciences de la nature, celle du tableau dichotomique. Un tableau dichotomique est un arbre qui se ramifie progressivement en ne laissant qu'un nombre limité d'embranchements (2 en théorie). A la racine de l'arbre se trouvent tous les objets qu'on désire identifier, alors que l'extrémité d'une branche ne contient qu'un objet unique.
I) Caracterisation de quelques cations :
Nous avons choisi les cations suivants, qui sont les plus couramment rencontrés dans l'enseignement secondaire :
Ag+, Pb2+, Hg2+ , Na+, K+, NH4+ , Zn2+ , Al3+ , Fe2+ , Fe3+ , Cu2+
Nous allons à l'aide de réactifs d'usage courant essayer de les distinguer à coup sûr les uns des autres. Pour cela nous allons tout d'abord dresser un tableau de résultats qui resumeront les tests effectués. Dans un deuxième temps nous utiliserons ces résultats pour construire un tableau dichotomique permettant la distinction des cations. Nous utiliserons ensuite ce tableau pour identifier un cation inconnu. Bien entendu il y a des indices tels que la couleur de la solution qui peuvent orienter fortement la recherche, mais nous avons choisi ici de présenter une technique utilisable directement par un élève qui n'aurait éventuellement jamais rencontré ces cations. Seuls les résultats des tests réellement effectués seront utilisés dans cette recherche.
1) Réalisation des tests :
Les réactifs utilisés sont :
Solution 0,1 M d'acide chlorhydrique ; solution 0,1 M de soude, solution 1 M de soude, solution 0,1 M d'ammoniaque, solution 1M d'ammoniaque, solution 0,1 M d'iodure de potassium, solution 1M d'iodure de potassium.
a) Test a HCl :
Dans un tube à essais verser 1 ml de la solution étudiée (liqueur primitive), rajouter goutte a goutte la solution de HCl 0,1 M. Observer la formation de precipités éventuels. Si un précipité est obtenu laisser le se décanter puis vider délicatement la solution surnageante. Verser alors de l'ammoniaque concentré sur le précipité, seul le chlorure d'argent se redissoudra.
b) Test à la soude :
Dans un tube à essais verser 1 ml de la solution étudiée, ajouter goutte a goutte la solution de NaOH 0,1 M. Observer la formation de précipités éventuels. Rajouter alors un exces de la solution de NaOH 1 M, observer une redissolution éventuelle.
c) Test a l'ammoniaque :
Dans un tube à essais verser 1 ml de la solution étudiée, ajouter goutte a goutte la solution de NH3 0,1 M. Observer la formation de précipités éventuels. Rajouter alors un excés de la solution de NH3 1 M, observer une redissolution éventuelle.
d) Test à l'iodure de potassium :
Dans un tube à essais verser 1 ml de la solution étudiée, rajouter goutte a goutte la solution de KI 0,1 M. Observer la formation de précipités eventuels. Rajouter alors un excés de la solution de KI 1 M, observer une redissolution éventuelle.
e) Test de la couleur de flamme :
Prendre un fil de fer (ou mieux de platine) ou plus simplement une spatule et le chauffer a la flamme. La flamme doit etre "incolore" (donc bleue en réalitée). Tremper le fil dans la solution étudiée puis le remettre a la flamme. Observer un eventuel changement de coloration de celle-ci.
f) Tests particuliers :
NH4+ / NaOH : Après avoir ajouté un excés de soude, chauffer le tube a essais. On observe un dégagement d'ammoniac que l'on peut caracteriser par un papier pH humide ou par la formation de fumèes blanches (NH4Cl solide en suspension dans l'air) si on approche un flacon de HCl concentré.
Fe3+ / KI : S'assurer que la solution utilisée a un pH < 3. On observe un changement de coloration de la solution du a la formation de diiode. On peut la mettre mieux en évidence par ajout d'un peu de tétrachlorure de carbone qui prendra une coloration rose puis violette par agitation.
Cu2+ / KI : Ici aussi il se forme du diiode, le caractériser comme precédemment. On observe aussi la formation d'un précipité blanc de CuI que l'on peut mieux mettre en évidence en décolorant la phase aqueuse par le thiosulfate de sodium.
2) Tableau de résultats des tests :
Ag+ |
Pb2+ |
Hg2+ |
Na+ |
K+ |
NH4+ |
Zn2+ | Al3+ | Fe2+ | Fe 3+ | Cu2+ | |
| HCl | PB |
PB |
X |
X |
X |
X |
X |
X |
X |
X |
X |
| NaOH | PN |
PB |
PN |
X |
X |
X |
PB |
PB |
PV |
PR |
PB |
| Exces | I |
I |
I |
X |
X |
DC |
S |
S |
I |
I |
I |
| NH3 | PN |
PB |
PN |
X |
X |
X |
PB |
PB |
PV |
PR |
PBL |
| Exces | S |
I |
I |
X |
X |
X |
S |
I |
I |
I |
S |
| KI | PJ |
PJ |
PRG |
X |
X |
X |
X |
X |
X |
I2 |
PB+I2 |
| Exces | I |
I |
S |
X |
X |
X |
X |
X |
X |
I2 |
PB+I2 |
| Flamme | X |
X |
X |
J |
L |
X |
X |
X |
X |
X |
V |
Légende :
X = Rien P = Precipite B = Blanc N = Noir J = Jaune
L = Lilas V = Vert R = Rouille RG = Rouge BL = Bleu
I2 = Formation de Diiode S = Soluble I = Insoluble
DC = Degagement de NH3 a Chaud
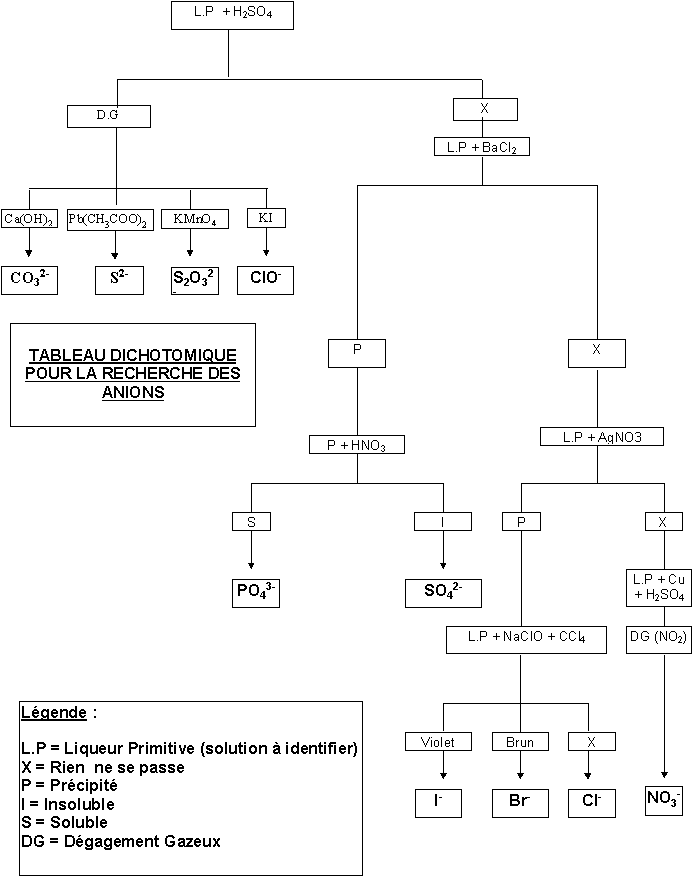
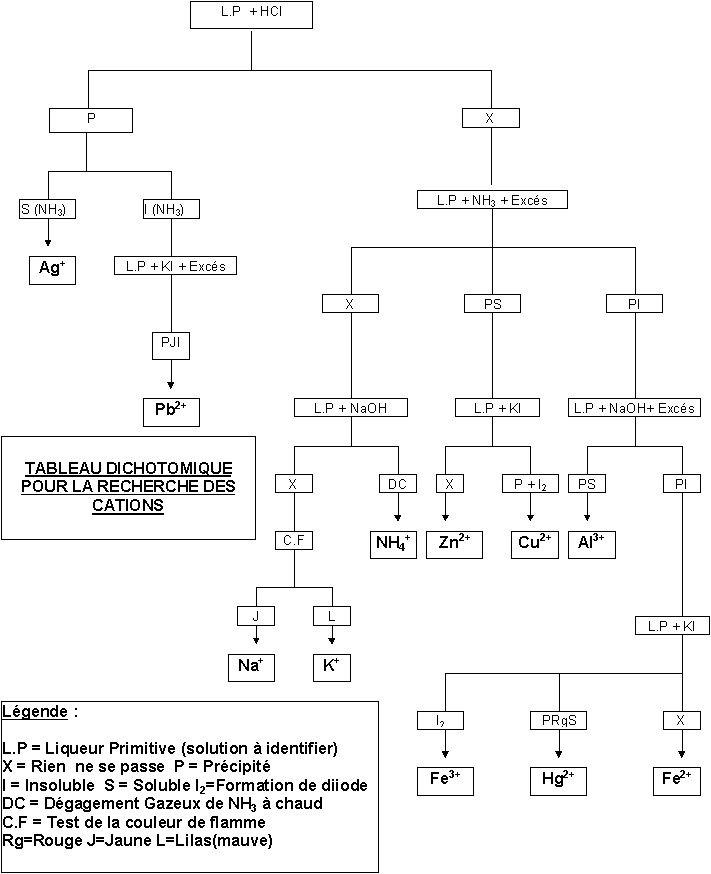
3) Construction du tableau dichotomique :
a) Identification de Ag+ et Pb2+
L'examen du tableau précédant montre que seuls Ag+ et Pb2+ donnent un chlorure insoluble. Ce test permet donc de les differencier des autres cations. Nous avons vu que seul AgCl est soluble dans l'ammoniaque on pourra donc le distinguer de PbCl2. On pourra confirmer la présence de Pb2+ par le test a l'iodure de potassium.
b) Identification de Na+, K+ et NH4+
Ces trois ions donnent un test négatif avec l'ammoniaque et la soude. On peut donc les distinguer des autres cations qui eux donnent un précipité. Si on opère à chaud, NH4+ se différencie par la formation de NH3. Enfin, le test de la couleur de flamme permet de distinguer Na+ de K+ .
c) Identification de Zn2+ et Cu2+
Tous deux donnent un précipité, soluble en excés, avec l'ammoniaque, alors que les autres cations non encore identifiés donnent un précipité insoluble. Le test à l'iodure de potassium permet de les distinguer l'un de l'autre puisque seul Cu2+ donne un test positif.
d) Identification de Al3+ , Fe2+, Fe3+ et Hg2+
Tout quatre donnent un précipité avec la soude, mais seul Al3+ donne un précipité soluble en excés. Le test a l'iodure de potassium permet en outre de distinguer Fe3+, Fe2+ et Hg2+. Pour le premier on observe la formation de diiode, le second donne un test negatif, enfin Hg2+ donne un précipité rouge soluble en excés.
4) Tableau dichotomique de recherche des cations : (voir pages suivantes)
5) Quelques tests spécifiques de vérification :
Quand on a identifié un cation grâce au tableau, on peut réaliser quelques tests supplémentaires pour confirmer. Bien entendu les tests effectués en début de manipulation (voir premier tableau) doivent donner un résultat identique. Le vérifier, on peut completer ensuite par les tests suivants.
Ag+ :
Test du miroir d'argent :
Dans un tube à essais introduire 2 ml de la solution, ajouter goutte a goutte de l'ammoniaque concentré. On observe la formation puis la redissolution d'un précipité noir. Ajouter alors quelques gouttes de solution de glucose et mettre au bain-marie. La formation d'un miroir d'argent confirme la présence de Ag+.
Zn2+:
* Complexe rouge avec la dithizone :
Dans un tube à essais verser 2 ml de solution étudiée, 2 ml de tampon acétique et 2 ml d'éthanol. Verser un peu de dithizone, une coloration rouge apparaît.
** Précipité avec le mercurithiocyanate de potassium
Dans un tube à essais verser 2 ml de solution étudiée, ajouter 1 ml de solution de mercurithiocyanate de potassium (K2Hg(SCN)4). Il se forme un precipite blanc de mercurithiocyanate de zinc.
Fe2+ :
* Decoloration d'une solution acidifiee de KMnO4 :
Dans un tube à essais verser 2 ml de solution étudiée, ajouter goutte a goutte une solution diluée de KMnO4 que l'on aura préalablement acidifiée par H2SO4. On doit observer une franche décoloration.
** Complexe rouge orangé avec l'orthophénanthroline :
A 1 ml de solution étudiée rajouter un cristal d'orthophénantroline, on observe la formation d'un complexe rouge orangé.
Fe3+ :
* Complexe rouge sang avec le thiocyanate de potassium :
Ajouter quelques gouttes de KSCN a la solution étudiée, un complexe rouge sang tres coloré apparaît.
Al3+ :
* Complexe rouge avec l'aluminon :
Dans un tube à essais verser 2 ml de tampon acetique et quelques gouttes d'aluminon. Verser quelques gouttes de la solution étudiée, une coloration rouge apparaît.
Pb2+:
* Précipitation du sulfate :
Ajouter un peu d'acide sulfurique 1 M a la solution étudiée, il se forme un précipité blanc.
** Précipitation du sulfure :
Dans un tube à essais introduire 2 ml de solution de sulfure de sodium 0,1 M puis 1 ml d'acide sulfurique 1 M. Il se forme un dégagement gazeux de H2S. Présenter alors un papier filtre imbibé de la solution étudiée à l'ouverture du tube, la formation de PbS fait noircir le papier.
Cu2+ :
* Couleur de flamme verte : (voir plus haut)
Hg2+ :
* Formation d'un amalgame :
Dans un petit becher verser la solution étudiée puis mettre à tremper une pièce de 5, 10 ou 20 centimes. Au bout de quelques instants vider le becher et rincer la pièce à l'eau. La frotter au papier filtre. La pièce de 20 centimes prend la couleur d'une piece de 1 franc. Il s'est forme un amalgame par dépôt de mercure sur l'alliage cuivré. Le dépôt terni et part à la longue.
Remarque :
La formation d'amalgames se fait avec la plupart des métaux, ainsi le mercure "attaque" les bijoux en or. Le traitement consiste à chauffer le bijoux à l'étuve pour évaporer le mercure.
II) Identification de quelques anions :
La démarche est identique a celle utilisée pour l'identification des cations. Les anions choisis sont : CO32- , S2-, S2O32-, ClO- , SO42- , PO43- , Cl- , Br- , I- et NO3-. Pour gagner du temps nous allons réaliser les tests dans l'ordre du tableau dichotomique celui-ci etant posé d'avance. Les ions identifiés seront éliminés de la liste au fur et à mesure.
1) Tests réalisés :
a) Test d'acidification par H2SO4 : ( CO32- , S2- , S2O32- , ClO-)
Dans un tube à essais introduire 3 ml de la solution étudiée et 1 ml d'acide sulfurique 5 M. Agiter et observer la formation d'un éventuel dégagement gazeux. Ne pas tenir compte de la formation de précipités.
Identification du gaz formé :
* Surmonter le tube à essais d'un tube à degagement et faire barboter le gaz dans de l'eau de chaux, observer la formation d'un trouble blanc éventuel. Seul CO32-donne un test positif (CO2). Pour faciliter ce test avec des solutions diluées on peut utiliser un montage plus complexe évitant les pertes de gaz, par exemple un erlen muni d’un tube a dégagement et d’une ampoule à addition.
** Approcher un papier à l'acétate de plomb et observer un noircissement éventuel. Seul S2- donne un test positif (H2S).
*** Approcher un papier imbibé de KMnO4 dilué acidifié et observer une éventuelle décoloration. Seul S2O32- donne un test positif (SO2). On notera de plus la formation lente d'un précipité blanc jaunâtre de soufre colloïdal par dismutation de S2O32- .
**** Approcher un papier imbibé de KI et observer un éventuel brunissement. Seul ClO- donne un test positif (Cl2).
b) Test au chlorure de baryum : (SO42- , PO43- )
Dans un tube à essai introduire 2 ml de la solution étudiée puis 1 ml de solution de BaCl2. Observer la formation d'un précipité. Laisser décanter, puis vider délicatement le surnageant. Essayer de dissoudre le précipité dans l'acide nitrique concentré, le phosphate est soluble et le sulfate ne l'est pas.
d) Test au nitrate d'argent : (Cl-, Br-, I-)
Dans un tube à essai introduire 2 ml de la solution étudiée puis 1 ml de solution de AgNO3. Observer la formation d'un précipité.
e) Test à l'hypochlorite (ou monooxochlorate) de sodium :(Cl-, Br-, I-)
Dans un tube à essai introduire 2 ml de la solution étudiée puis 1 ml d'eau de Javel. Agiter, puis verser 1 ml de tétrachlorure de carbone et observer un éventuel changement de sa coloration. Avec I-, CCl4 se colore en rose puis violet, il y a eu formation de diiode. Avec Br-, CCl4 se colore en brun rougeâtre, il y a eu formation de dibrome. Il ne se passe rien avec Cl-.
Remarque : CCl4 présentant une toxicité relativement élevée on pourra si on le désire le remplacer par l’hexane par exemple. La phase organique sera alors moins dense que l’eau.
f) Test d'oxydation du cuivre : (NO3-)
Dans un tube a essais introduire 2 ml de solution étudiée et 1 ml d'acide sulfurique concentré. Introduire une tournure de cuivre et chauffer. L'attaque du cuivre avec formation de vapeurs rousses caractérise NO3- .
2) Tableau Dichotomique de recherche des Anions : (Voir pages suivantes)
III) Dosages d'ions :
Dosage des ions MnO4- ou Fe2+ : Voir thème N°12
Dosage des ions Ag+ ou Cl- : Voir thème N° 14
Dosage des ions Zn2+ : voir thème N° 15
Dosage des ions Cu2+ : voir thème N°16
Dosage des ions Ca2+ et Mg2+ : Voir thème N°15
Dosage des ions Al3+ : voir thème N°16